記事
生活の速度での高解像度、多色3Dイメージング
革新的なレーザ蛍光技術である掃引共焦点配置平面励起(SCAPE)顕微鏡は、
これまでの手法の限界を克服し、幅広いライフサイエンスユーティリティを提供します。
概要
ライフサイエンスのさまざまな分野の研究者たちは共通して、高速、高画素数、単一細胞解像度という特徴を持ち、標本に大きな光損傷をもたらさずに画像を取得できる3D蛍光顕微鏡ツールを必要としています。しかし、数多くの開発や技術的改良が行われてきたにもかかわらず、確立されたほとんどの技術には、これらのパラメータのうち妥協しなければならない点が少なくとも1つ含まれます。
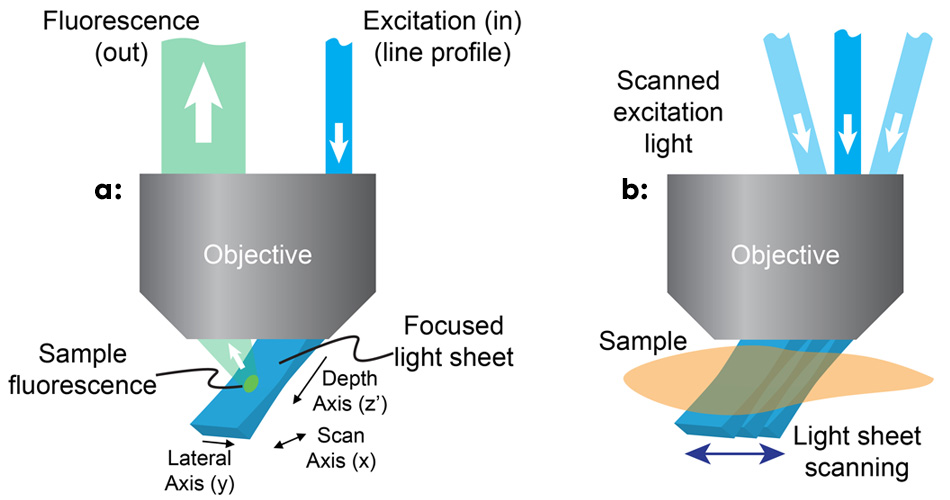
図1: SCAPEでは、ラインプロファイルビームを使用した主要な顕微鏡の対物レンズのオフアキシス照明によってライトシートが斜角で生成されます(a)。SCAPEは、照射された一連の平面画像をキャプチャしながらライトシートをスキャンすることによって容積測定画像を構築します(b)。
進歩と妥協点
たとえば、単一のスポットを物理的にスキャンする速度には限界があるため、共焦点顕微鏡はマルチヘルツ繰返周波数で高解像度の大量のxyz面を画像化することができません。さらに、ピクセルあたりの短い滞留時間により、最速の共焦点スキャンには高いレーザ出力が必要となり、生きたサンプルに重大な光損傷をもたらしてしまいます。
2光子顕微鏡は光損傷を劇的に低減させますが、そのようなシングルポイントアプローチでは、速度/解像度/量の妥協に起因する同じ問題に直面することになります。最近開発された高速音響光学モジュレーター(AOMs)により、事前に選択された少量のより高速なスキャンが可能になりました。しかし、大量の生物または動く生物の場合、このアプローチには限界があります。
従来のライトシート顕微鏡は、xy面全体を同時にサンプリングできますが、これには横方向のサンプルアクセス(およびそのための特別な準備)と3Dデータのキューブを構築する時間が必要となります。さらに、オプティクスの同期とステージモーションが原因で、これらの技術は複雑で時間がかかります。
コロンビア大学のZuckerman Mind Brain Behavior Institute(ニューヨーク州、ニューヨーク市)のエリザベス・ヒルマン教授とそのチームは、取り付けおよび非取り付けサンプル形状を幅広くサポートしながらも、これらの問題を回避する革新的なアプローチを開発しようと計画しました。このチームが生み出した成果は、2015年の文書で初めて発表された掃引共焦点配置平面励起(SCAPE)顕微鏡です。1 更新バージョンのSCAPE 2.0は2019年に報告され2、その幅広いライフサイエンスユーティリティを認識したLeica Microsystemsによりライセンスが供与されました。
SCAPEの仕組み
ヒルマン教授は次のように説明しています。「超高速度イメージングが、シングルポイントまたはマルチポイントスキャンから生み出されることはないだろうと考えていました。必要としているスキャン速度を得られたとしても、各ピクセルの滞留時間が短すぎるので、許容できる信号対雑音比で画像を取得することはできません。そこで考え出したのがライトシート顕微鏡です。当時のほとんどすべてのシステムでは、サンプルの周りに2つの対物レンズを互いに90 °で配置する必要がありました。そのため、ライトシートのマルチピクセルの利点を単一対物構成の中に組み合わせることができるのかという疑問が生じました」。
このチームは、高開口数対物レンズの端を通してオフアキシスパスを使用すると顕微鏡の真のxy面に対して45°で励起ライトシートを生成できることに気付きました(図1)。この斜面から発せられる蛍光を画像化するために、斜面顕微鏡と同様の方法を用いて対物レンズのイメージング面を回転させ、カメラの焦点を正確に合わせました。3 ヒルマン教授とそのチームは、対物レンズ上流のスキャンミラーを使用してライトシートを左右に移動させ、戻ってくる蛍光の向きを直して移動するライトシートに焦点を合わせられるようにしています。ミラーが動くにつれて面を重ねることにより、顕微鏡は3Dボリュームの画像を迅速に繰り返し生成することができます。
SCAPE 2.0(図2)のいくつかの詳細では、メリットを説明しています。傾斜面(視野角に対して斜めにあるライトシート)の画像化の問題は、第2の対物レンズを使用して中間点で本格的な斜視画像を作成するためにキャプチャされた蛍光をリレーすることにより対処できます。その後、この画像は斜め(約127 °)に配置された第2の対物レンズを通して撮影され、ライトシートの面がカメラ上に平らになるように焦点を合わせます。
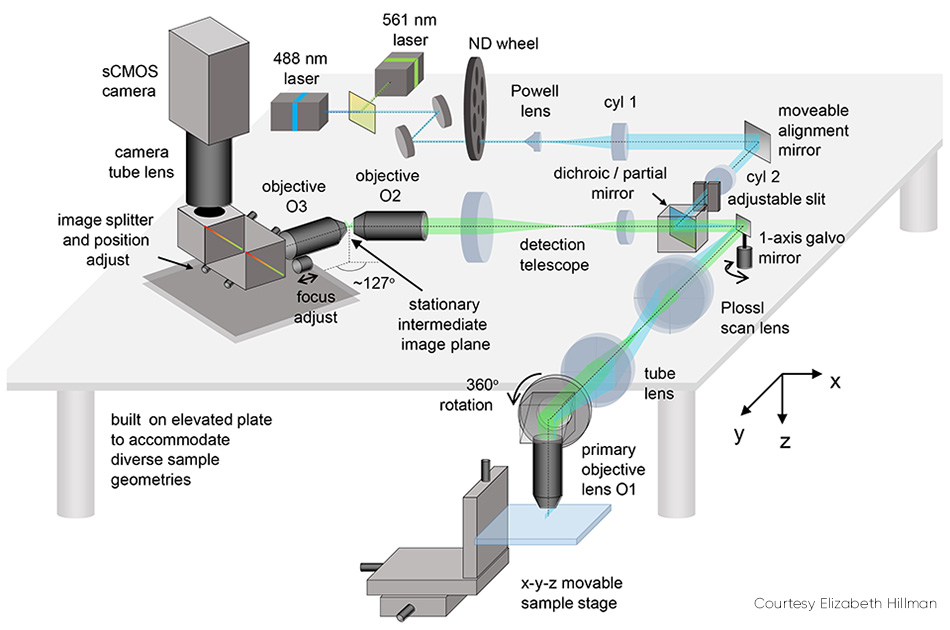
図2: 可動アライメントミラーはSCAPE 2.0の重要な要素の1つです。
カメラの最終画像は、サンプル内のy-z斜面であり、通常は長方形です。ほとんどの細胞組織に対する光の溶け込みには限界があるため、(yに対して)z方向へ狭くなります。このようなサンプルの場合、減少した行数のみ読み出すようカメラを操作すると便利です。そうすれば、使用されるカメラに応じて1000から18,000 fpsの間に200行を読み出すなど、より高速な画像化が可能になります。
スキャン同期の問題は、ポリゴンミラーを使用してライトシートをスキャンすることにより初めて解決されました。検出パスには、励起光によって使用されたファセットに隣接するファセットが含まれていました。ヒルマン教授は次のように説明しています。「このポリゴンはSCAPEのオリジナルインスピレーションでしたが、単一のガルバノミラーを使用したほうがずっとシンプルで効果的であることにすぐに気付きました。この変更により、システム構築がより簡単で安価に行えるようになり、より多くの光がカメラに戻り、システムのスキャンパターンをより簡単に制御できるようになっています」。
ガルボミラー以外の可動部品がないため、SCAPEの全体速度はカメラのフレームレートとSN比(SNR)によってのみ制限されます。特定の実験に応じて、ガルボミラーは10から100 Hzの間でスキャンされ、1秒につき10~100ボリューム(vps)という前例のない速度が実現します。SCAPEは、従来の鋸歯スキャンパターン(リニアスイープの後にほぼ瞬時のリセット)を使用します。ガルボのスイープの振幅と1スイープあたりのカメラフレーム数により、システムの視野とx方向のサンプリング密度が決まります。より速いカメラを使用すると、ボリュームレート、サンプリング密度、視野を向上させることができます。チームのほとんどのイメージングでは標準sCMOSカメラが使用されていましたが、インテンシファイアを内蔵した超高速CMOSカメラを使用したところ、イメージングが300 vpsを上回りました。
ライトシートは画像視野角zに対して斜めに掃引されているので、各深さスライスには隣のスライスに対してわずかなオフセットが生じます。顕微鏡のコンピュータはシンプルな変換を使用してこの「ねじれ」を修正し、歪みのない3Dイメージボリュームを生成します。
デジタルレーザ変調
機能性インジケータと蛍光タンパク質を含む複数のフルオロフォアの同時監視により、ダイナミックな挙動(例:筋肉の働き)と分子組成、細胞構造、神経信号などとの相関が可能になります。SCAPEは、プラグアンドプレイCoherent OBIS光励起半導体レーザ(OPSL)を介して、スペクトルが分離された2つ以上の画像をカメラ上で横並びに同時取得するオプションを備えた多波長励起を提供することにより、そのような用途をサポートしています。
ヒルマン教授は以前のレーザタイプと比較して、この作業におけるOPSL技術の革新的な利点をいくつか挙げています。同教授は、使用可能な幅広い波長と出力レベルに注目しています。「数年前は、使用可能な出力レベルとして、488 nm、532 nm、638 nmしかありませんでした。イエローとオレンジの選択肢はありませんでした。しかし今では、一般的に使用可能なほとんどのフルオロフォアの励起に近似しており、波長が数十および数百ミリワットのレーザ光源を選ぶことができます」。同教授は、SCAPEシステムのほとんどで複数のフリースペースレーザを統合することで、ファイバー結合よりも柔軟性が高くなっている、と説明します。「レーザはコンパクトで、すべて同じフォームファクタと電子インターフェースなので非常に便利です」 とヒルマン教授は言い、これまでに、一部の実験で最大5つのレーザ波長を使ったと述べています。また、定期的にSCAPEをワークショップやコースに持って行き、利用可能なOBISレーザを最小限の再調整で使用しているとも説明しています。
OPSLのもう1つの重要な特徴は、デジタルイメージングです。OPSLは最大25 kHzの速度でオンとオフを切り替えることができるので、励起波長を連続フレームにて正確なタイミングで交互に切り替えることができます。これは、ラボ生産のダイクロイックフィルターとミラーから成るイメージスプリッターを使用した多波長検出によって補完されています。このデバイスは、単一波長動作と比較してイメージング速度に影響を与えず、最大1280ボクセル幅の画角を持つスペクトル分離型画像を投写します。
出力と幅の実証
最近行われた2つの共同研究は、SCAPEの出力と幅を示しています。
神経科学では、体全体、脳、神経系を含む小型生物のイメージングがトレンドとなっています。ヒルマン教授とそのチームは最近、生きたショウジョウバエの幼虫内にある、遺伝的にコード化されたカルシウムに反応する蛍光タンパク質の高速3Dイメージングについての研究を発表しました(図3)。チームは、蠕動爬行中の幼虫の体と神経系の複雑なダイナミクスをキャプチャしただけでなく、変形するにつれて体壁沿いのニューロンが発火する流れを把握することもできました。
また、チームはSCAPEを使用して、生きた齧歯動物の皮質5 のニューロンデンドライトのダイナミックな発火と、マウスの鼻の嗅覚ニューロンの研究を行いました6 。また、自由に動く 線虫 全体を画像化しました。さらに、胎生期のゼブラフィッシュの鼓動している心臓に関するドラマチックなビデオを制作しました。2
胎生期のゼブラフィッシュの心臓の研究は、遺伝要因と環境要因が構造と機能に及ぼす影響を含む脊椎動物の心臓の発達に関する考察の助けとなります。従来の顕微鏡検査ではゲーティング時間が必要とされるため、2~4 Hzの自然心拍数における不整脈などの詳細を見落としていました。さらに、赤血球(RBC)のフロー分析のための完全な4D粒子追跡を行うこともできませんでした。ヒルマン教授のチームは、小児心臓専門医であるキマラ・ターゴフ教授と共同研究を実施しました。ターゴフ教授の研究室では、ゼブラフィッシュを使用して胎芽内の心臓の異常を引き起こす可能性がある遺伝子変異を解明しています。この共同努力の結果、鼓動する心臓を赤血球が100 vpsを超える速度で流れる映像が撮影され、GCaMPラベル製作を活用することにより、鼓動する心臓全体を流れるカルシウム活動の各波も撮影されました(図4)。
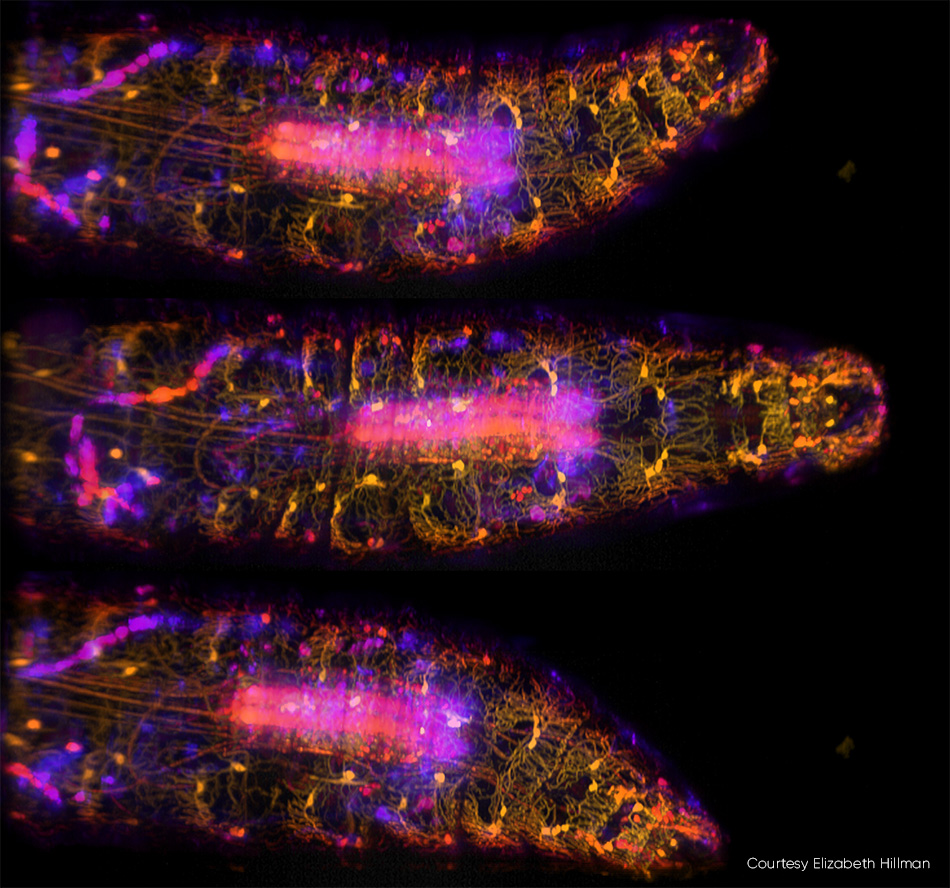
図3:10 vpsのSCAPE 2.0で撮影された動くショウジョウバエの幼虫の画像3枚[3]では、GFPによって腹側固有受容ニューロンがラベル製作され、488 nm励起で画像化されています。色(イエローからブルー)は、さまざまな深さからサンプルへの信号を示しています。詳細については、R. Vaadia et al. [4]を参照してください。この研究のリアルタイムビデオシーケンスについては、http://bit.ly/SCAPE2019をご覧ください。
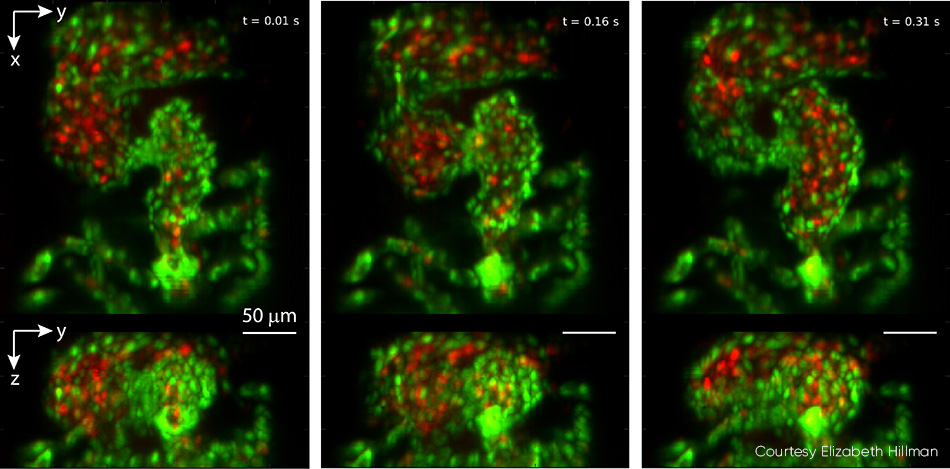
図4:ビデオから抜粋されたこの3枚続きの画像は100 vpsで撮影され、リアルタイムで鼓動しているゼブラフィッシュの心臓が示されています。上部パネルはz投影を示し、下部パネルはx投影を示しています。心臓の心室は、流出弁が開いている状態で圧縮され始め、連続画像では心房から満たされます。心臓壁の内皮細胞はEGFP(グリーン)でラベリングされ、赤血球はDsRed(レッド)でラベリングされます。両方のフルオロフォアは488 nmレーザ光で励起されました(サンプルでは0.6 mW)。映像を含む詳細については、次を参照してください。V. Voleti et al. [2]
概要
ライフサイエンス全体で、研究者たちは蛍光顕微鏡を使うことによって、分子、細胞、臓器、生物レベルでのイベントをつなげることができています。高解像度多色(3D)画像を生活の速度で記録する能力(4D顕微鏡)は、この研究の加速化における重要な鍵となりつつあります。
参考資料
参考文献
1. M. B. Bouchard et al., Nat. Photonics, 9, 2, 113–119 (2015).
2. V. Voleti et al., Nat. Methods, 16, 10, 1054–1062 (2019).
3. C. Dunsby, Opt. Express, 16, 25, 20306–20316 (2008).
4. R. Vaadia et al., bioRxiv, 467274 (2018).
5. E. M. Hillman et al., Curr. Opin. Neurobiol., 50, 190–200 (2018).
6. L. Xu et al., Science, 368, 6487, eaaz5390 (2020).