文章
与时俱进的高分辨率多波长 3D 成像
采用激光荧光技术的创新型扫描共聚焦平面激发 (SCAPE) 显微镜
克服早期方法的局限性并提供广泛的生命科学用途。
综述
生命科学不同领域的研究人员对 3D 荧光显微镜工具有着共同的需求,这些显微镜拥有高速、高像素数和单细胞分辨率的特点,并且可以在不对样品造成显著光损伤的情况下获取图像。但是,尽管已经取得了巨大的发展和技术改进,但大多数成熟技术仍然需要权衡,不可避免地妥协其中至少一个参数。
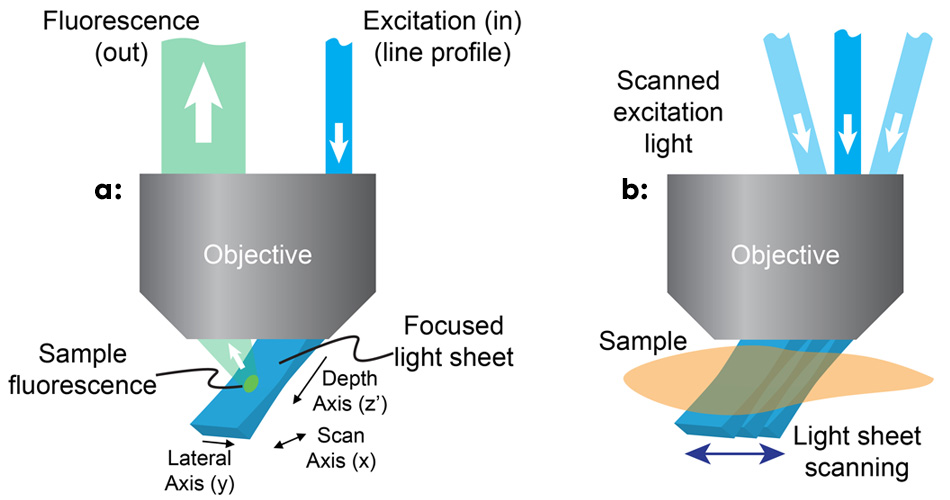
图 1:在 SCAPE 中,通过使用线轮廓光束对主显微镜物镜进行离轴照射,以倾斜角度形成光片 (a);SCAPE 通过扫描该光片来构建体积图像,同时捕获所照射平面的一系列图像 (b)。
进步与权衡
例如,由于物理扫描单个光斑时的速度限制,共聚焦显微分析无法在变频重复频率下以高分辨率对大 xyz 体积进行成像。此外,每个像素的停留时间很短,这意味着最快的共聚焦扫描需要高激光功率,从而对活样品造成严重的光损伤。
虽然双光子显微成像可显著减轻光损伤,但这种单点方法面临着同样的问题,即速度/分辨率/体积的权衡。最近开发的快速声光调制器 (AOM) 可以更快地扫描预先选择的小体积,但这种方法对于大体积或移动的生物体的用途有限。
传统光片照明显微镜可以同时对整个 xy 平面进行采样,但它需要横向取样(因此需要特殊准备),并需要时间才能构建 3D 数据立方体。此外,光学器件和载物台移动同步使这些技术复杂而缓慢。
哥伦比亚大学祖克曼大脑行为研究所 (Zuckerman Mind Brain Behavior Institute)(纽约州纽约市)的 Elizabeth Hillman 教授和她的同事着手开发一种创新方法,以期避开这些限制,同时支持各种封装和未封装的各种形状的样品。他们最终成功开发出了扫描共聚焦平面激发 (SCAPE) 显微镜,该显微镜最初见诸于 2015 年的一篇出版物。1 2019 年报告了更新版本 SCAPE 2.0,2,Leica Microsystems 认识到其广泛的生命科学功用,现已获得该显微镜的使用许可。
SCAPE 的工作原理
Hillman 解释说:“我们推断,单点甚至多点扫描可能永远也无法实现真正的高速成像。即使我们可以获得所需的扫描速度,但每个像素的停留时间太短,无法获得信噪比可接受的图像。所以,我们开始考虑光片照明显微镜。当时几乎所有系统都需要两个物镜,在样品周围相互成 90°。于是问题就变成了我们能否将光片的多像素优势结合到单物镜配置中?”
团队意识到,通过高数值孔径物镜的边缘使用离轴路径会在与显微镜的实际 xy 平面成 45° 的角度形成激发光片(见图 1)。为了对来自这个倾斜平面的荧光进行成像,他们旋转了物镜的成像平面,使用类似于倾斜平面显微镜的方法精确聚焦相机。3 Hillman 和她的团队使用物镜上游的扫描镜从一侧向另一侧移动光片,这还会重定向返回的荧光,以使焦点保持在移动的光片上。通过在扫描镜移动时堆叠平面,显微镜可以快速、重复地生成 3D 体积图像。
SCAPE 2.0 的一些细节(见图 2)有必要进行说明。通过中继捕获的荧光以使用第二个物镜在一个中间点形成实际倾斜图像,解决了倾斜平面成像(即光片与查看轴之间成一定角度)问题。然后通过第二个物镜捕获此图像,物镜以一定角度(大约 127°)布置,以将光片平面水平聚焦到相机上。
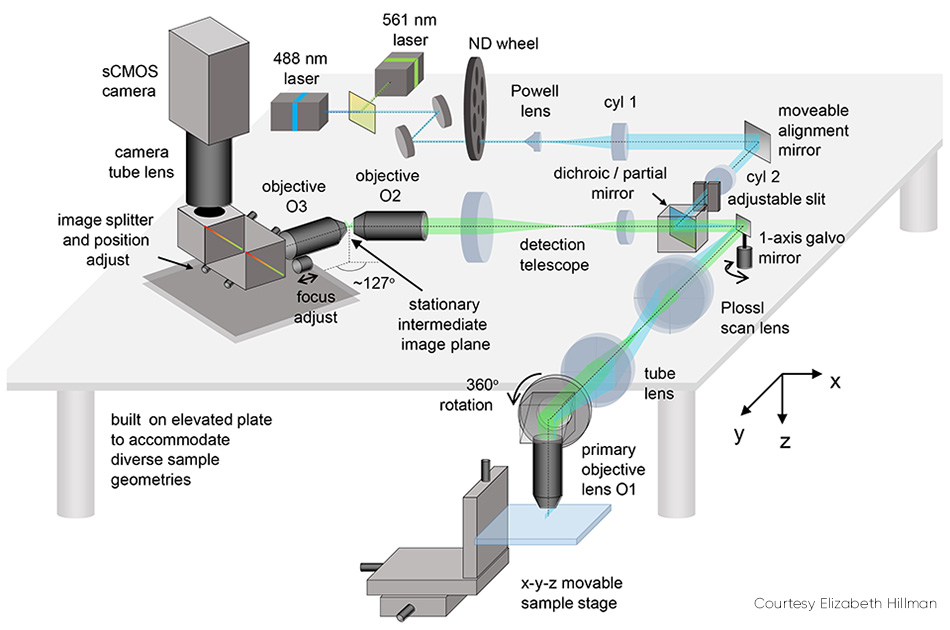
图 2:活动式校准镜是 SCAPE 2.0 的关键元件之一。
相机上的最终图像是样品内的倾斜 y-z 平面,通常是矩形;由于光线对大多数组织的穿透力有限,它在 z 方向(相对于 y)更窄。在此类样品中,操作相机仅读取更少的行数(对应于 z 方向的深度)很有用,因为这可实现更高速度的成像。例如,可以在 1000 到 18,000 fps 之间的速度下读取 200 行,具体取决于使用的相机。
通过使用多面镜来扫描光片,首次解决了扫描同步问题。检测路径包含与激发光使用的面相邻的面。Hillman 解释说:“这个多面镜是 SCAPE 的最初灵感来源,但我们很快意识到使用单个振镜将会更简单,并且同样有效。这一变化使系统制造起来更简单、更经济,可以让更多光线返回相机,并且更容易控制系统的扫描模式。”
除了振镜外没有其他移动部件,因此,SCAPE 的整体速度仅受相机帧速率和信噪比 (SNR) 的限制。根据具体实验,以 10 到 100 Hz 的频率扫描振镜,相当于前所未有的 10-100 体积/秒 (vps)。SCAPE 使用传统锯齿扫描模式,即线性扫描后进行准瞬时重置。振镜的扫描幅度和每次扫描的相机帧数决定了系统的视野和 x 方向的采样密度。可以利用更快的相机来提高体积速率、采样密度或视野。虽然团队的大部分成像都使用标准 sCMOS 相机,但他们使用带有集成增强器的超快 CMOS 相机实现了超过 300 vps 的成像。
由于扫描的光片与图像查看轴 z 成一定角度,因此,每个深度切片相对于下一个切片均略有偏移。显微镜的计算机使用简单变换来纠正这种“倾斜”并生成无失真的 3D 图像体积。
数字激光调制
同时监测多个荧光团(包括功能指标和荧光蛋白)可以将动力学行为(例如肌肉动作)与分子组成、细胞结构、神经信号等相关联。SCAPE 通过即插即用的 Coherent OBIS 光泵浦半导体激光器 (OPSL) 提供多波长激发,轻松支持此类应用,并可选择在相机上同时并排获取两个或多个光谱分离的图像。
Hillman 指出,与早期的激光类型相比,OPSL 技术在这项工作中的几个创新优势。她注意到了各种可用波长和功率级。“几年前,如果需要可用的功率级,我们可以使用 488 nm、532 nm 和 638 nm,差不多仅此而已。在黄光和橙光范围内,我们别无选择。但如今,我们可以选择几十到几百毫瓦的激光源,其波长可与几乎任何常用荧光团的激发精确匹配。” 她解释说,他们的大多数 SCAPE 系统都集成了多个自由空间激光器,为他们提供了比光纤耦合更高的灵活性。“激光器结构紧凑,外形尺寸都完全相同,电子接口也别无二致,使用起来非常方便。” Hillman 说,迄今为止,他们在一些实验中已经使用了多达五种激光波长。她还解释说,她经常将 SCAPE 带到研讨会和培训课程中,并使用可用的 OBIS 激光器,极少需要重新校准。
数字成像是 OPSL 激光器的另一个重要功能。由于 OPSL 激光器能以高达 25 kHz 的速度打开和关闭,因此,激发波长可以在精确定时的连续帧上交替。通过使用实验室构建的图像分割器(由二向色滤光片和滤光镜组成)进行多波长检测,可以对此功能进行补充。该设备可投射光谱分离的图像,视野宽达 1280 体素,与单波长操作相比,对成像速度没有影响。
展示能力和范围
最近的两项合作研究说明了 SCAPE 的能力和范围。
小生物体成像(包括整个身体、大脑和神经系统)是神经科学的一个趋势。Hillman 及其同事最近发表了一项研究,描述了他们对活果蝇幼虫中基因编码和钙敏感荧光蛋白的高速 3D 成像(见图 3)。除了捕获幼虫在蠕动爬行过程中身体和神经系统的复杂动力学特征外,团队还跟踪了沿体壁分布的神经元在变形时的放电方式。
团队还使用 SCAPE 研究了活体啮齿动物脑皮层中神经元树突5 和小鼠鼻内嗅感觉神经元 6 的动态放电过程,并对自由移动的整个秀丽隐杆线虫蠕虫进行了成像。此外,他们还制作了斑马鱼胚胎心脏跳动的戏剧性视频。2
通过研究斑马鱼胚胎心脏,可以深入了解脊椎动物的心脏发育,包括遗传和环境因素对结构和功能的影响。传统显微分析需要时间选通,在自然心率为 2 至 4 Hz 的情况下,这不可避免地会遗漏诸如不规则心律失常等细节,并且它无法对红细胞 (RBC) 流动分析执行全 4D 颗粒跟踪。Hillman 的团队与小儿心脏病学专家 Kimara Targoff 教授合作,后者的实验室使用斑马鱼来破译可能导致胚胎心脏畸形的基因突变。通过合作,他们以超过 100 vps 的速率捕获了心跳过程中红细胞的视频,并利用 GCaMP 标记捕获了整个心跳过程中钙活性的单独波形(见图 4)。
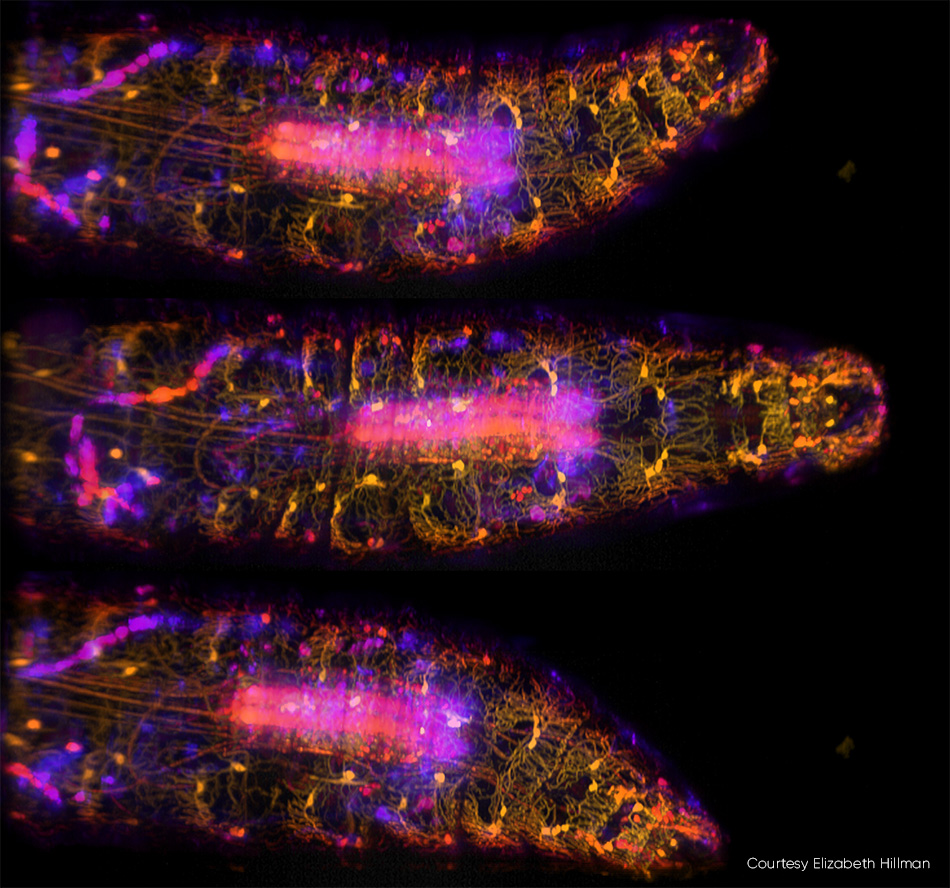
图 3:在由 SCAPE 2.0 以 10 vps 的速率捕获的这三幅移动果蝇幼虫图像中 [3],用 GFP 标记了腹侧本体感受神经元,并使用 488 nm 激发进行了成像。颜色(从黄色到蓝色)表示从不同深度进入样品的信号。有关详细信息,请参见 R. Vaadia 等人的研究 [4];有关该研究的实时视频序列,请访问 http://bit.ly/SCAPE2019。
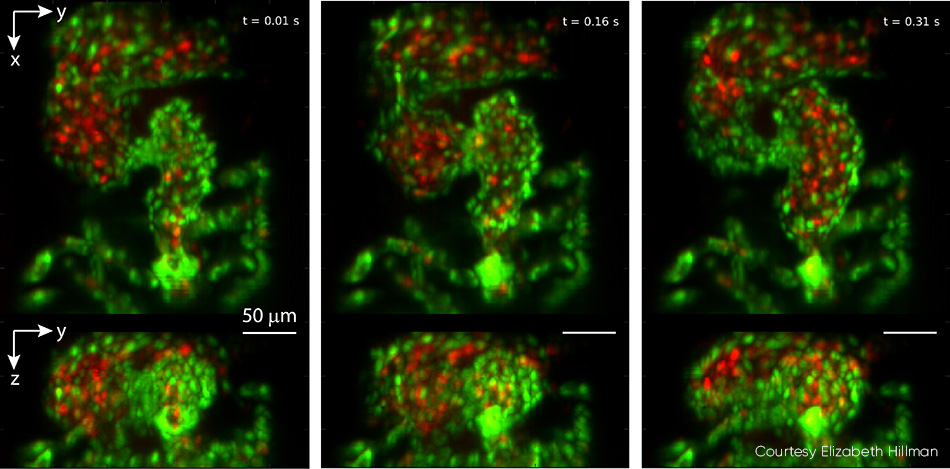
图 4:此三联图像取自以 100 vps 的速率捕获的斑马鱼实时心跳视频。顶部面板显示 z 投影,底部面板显示 x 投影。在连续的图像中,心室开始被压缩,流出瓣打开,然后由心房充满。心脏壁的内皮细胞用 EGFP(绿色)标记,而红细胞用 DsRed(红色)标记。两个荧光团均用 488 nm 激光激发(在样品上的功率为 0.6 mW)。有关完整的详细信息(包括视频),请参见 V. Voleti 等人的研究 [2]
总结
在整个生命科学领域,研究人员可以通过荧光显微分析手段在分子、细胞、器官和生物体水平将事件联系在一起。与时俱进地记录高分辨率多色 (3D) 图像的能力(4D 显微分析)现已准备好在加速此研究方面发挥关键作用。
参考文献
参考文献
1. M. B. Bouchard et al., Nat. Photonics, 9, 2, 113–119 (2015).
2. V. Voleti et al., Nat. Methods, 16, 10, 1054–1062 (2019).
3. C. Dunsby, Opt. Express, 16, 25, 20306–20316 (2008).
4. R. Vaadia et al., bioRxiv, 467274 (2018).
5. E. M. Hillman et al., Curr. Opin. Neurobiol., 50, 190–200 (2018).
6. L. Xu et al., Science, 368, 6487, eaaz5390 (2020).