ARTIKEL
Hochauflösende, mehrfarbige 3D-Bilder in lebensnaher Geschwindigkeit
Eine innovative Laser-Fluoreszenztechnik, die SCAPE-Mikroskopie (Swept Confocally Aligned Planar Excitation),
überwindet die Grenzen früherer Methoden und bietet einen breiten Nutzen für die Biowissenschaften.
Überblick
Forscher in verschiedenen Bereichen der Biowissenschaften haben einen gemeinsamen Bedarf an 3D-Fluoreszenzmikroskopie-Tools, die sich durch eine hohe Geschwindigkeit, eine hohe Pixelzahl und eine Einzelzellauflösung auszeichnen und Bilder aufnehmen können, ohne das Präparat erheblich zu beschädigen. Trotz zahlreicher Entwicklungen und technischer Verbesserungen sind die meisten etablierten Techniken jedoch immer noch mit Kompromissen verbunden, die mindestens einen dieser Parameter beeinträchtigen.
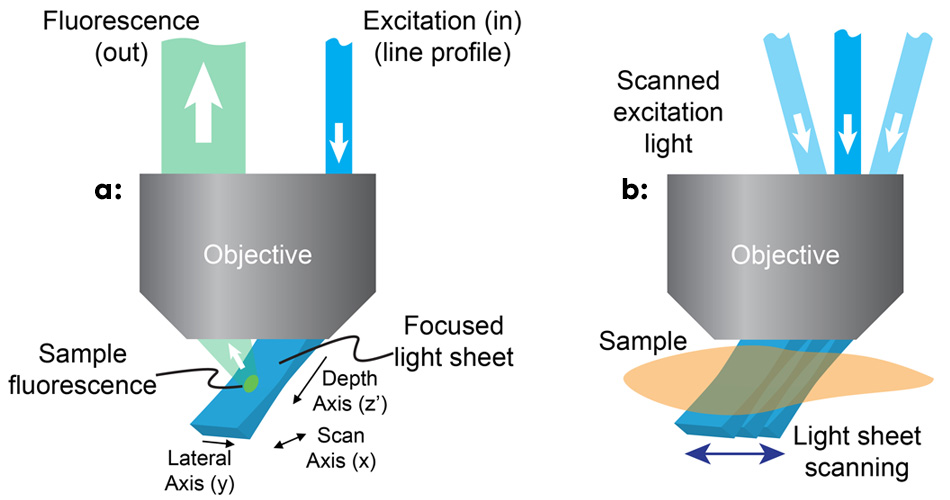
Abbildung 1: Bei SCAPE wird ein Lichtblatt in einem schrägen Winkel durch eine außeraxiale Beleuchtung des primären Mikroskopobjektivs mit einem Linienprofilstrahl gebildet (a). SCAPE erstellt ein volumetrisches Bild durch Scannen des Lichtblattes, während eine Reihe von Bildern der beleuchteten Ebene aufgenommen wird (b).
Fortschritte und Kompromisse
Zum Beispiel kann die konfokale Mikroskopie kein großes xyz-Volumen mit hoher Auflösung bei Multihertz-Wiederholraten abbilden, da die Geschwindigkeit beim Scannen eines einzelnen Punktes begrenzt ist. Darüber hinaus bedeutet die kurze Verweildauer pro Pixel, dass die schnellsten konfokalen Scans eine hohe Laserleistung erfordern, was zu einer erheblichen Photobeschädigung der lebenden Proben führt.
Und während die Zwei-Photonen-Mikroskopie die Lichtschäden drastisch reduziert, stehen solche Ein-Punkt-Ansätze vor den gleichen Problemen, die sich aus dem Kompromiss zwischen Geschwindigkeit, Auflösung und Volumen ergeben. Kürzlich entwickelte schnelle akusto-optische Modulatoren (AOMs) ermöglichen nun ein schnelleres Scannen von kleinen, vorselektierten Volumina. Jedoch ist dieser Ansatz für große Volumina oder sich bewegende Organismen nur begrenzt geeignet.
Mit der herkömmlichen Lichtblattmikroskopie kann eine gesamte xy-Ebene gleichzeitig abgetastet werden, aber sie erfordert einen seitlichen Probenzugang (und damit eine spezielle Vorbereitung) sowie Zeit, um einen Würfel mit 3D-Daten aufzubauen. Darüber hinaus macht die Synchronisierung der Optik und der Bewegung des Objekttischs diese Techniken komplex und langsam.
Professor Elizabeth Hillman und ihre Kollegen am Zuckerman Mind Brain Behavior Institute der Columbia University (New York, NY) haben einen innovativen Ansatz entwickelt, der diese Einschränkungen vermeidet und gleichzeitig eine Reihe von montierten und unmontierten Probengeometrien unterstützt. Ihr erfolgreiches Ergebnis ist die Swept Confocally Aligned Planar Excitation (SCAPE) Mikroskopie, die erstmals in einer Veröffentlichung vom Jahr 2015 beschrieben wurde.1 Eine aktualisierte Version, SCAPE 2.0, wurde im Jahr 20192 veröffentlicht. Leica Microsystems hat den breiten Nutzen für die Biowissenschaften erkannt und die Software lizenziert.
Wie SCAPE funktioniert
Hillman erklärt: „Wir sind zu dem Schluss gekommen, dass eine wirklich schnelle Bildgebung wahrscheinlich niemals durch Einzel- oder gar Mehrpunkt-Scans erreicht werden kann. Selbst wenn wir die erforderliche Scangeschwindigkeit erreichen könnten, wäre die Verweilzeit für jedes Pixel zu kurz, um Bilder mit akzeptablem Signal-Rausch-Verhältnis zu erhalten. Also begannen wir, über Lichtblattmikroskopie nachzudenken. Fast alle Systeme dieser Zeit benötigten zwei Objektive, die in einem Winkel von 90° zueinander um die Probe herum angeordnet waren. Es stellte sich also die Frage, ob wir die Vorteile eines Lichtbogens mit mehreren Pixeln in einer Ein-Ziel-Konfiguration kombinieren können.“
Das Team erkannte, dass die Verwendung eines außeraxialen Pfades durch die Kante eines Objektivs mit hoher numerischer Apertur die Erzeugung eines Anregungslichtbogens in einem Winkel von etwa 45° zur wahren xy-Ebene des Mikroskops ermöglichen würde (siehe Abb. 1). Um die Fluoreszenz aus dieser schrägen Ebene abzubilden, drehten sie die Abbildungsebene des Objektivs, um die Kamera präzise zu fokussieren. Dabei verwendeten sie einen Ansatz, der der Mikroskopie mit schräger Ebene ähnelt.3 Hillman und ihr Team verwenden einen Scannerspiegel vor dem Objektiv, um das Lichtblatt von einer Seite zur anderen zu bewegen, wodurch auch das zurückkehrende Fluoreszenzlicht umgelenkt wird, um den Fokus auf dem sich bewegenden Lichtblatt zu halten. Durch das Stapeln der Ebenen bei der Bewegung des Spiegels kann das Mikroskop schnell und wiederholt Bilder von 3D-Volumina erzeugen.
Einige Details von SCAPE 2.0 (siehe Abb. 2) sind erklärungsbedürftig. Das Problem der Abbildung einer schiefen Ebene (d. h. eines Lichtbogens, der in einem Winkel zur Sichtachse steht) wird gelöst, indem die aufgenommene Fluoreszenz weitergegeben wird, um ein echtes Schrägbild an einem Zwischenpunkt mit Hilfe eines zweiten Objektivs zu erzeugen. Dieses Bild wird dann durch eine zweite Objektivlinse aufgenommen, die in einem Winkel (ca. 127°) angeordnet ist, um die Ebene des Lichtblattes flach auf eine Kamera zu fokussieren.
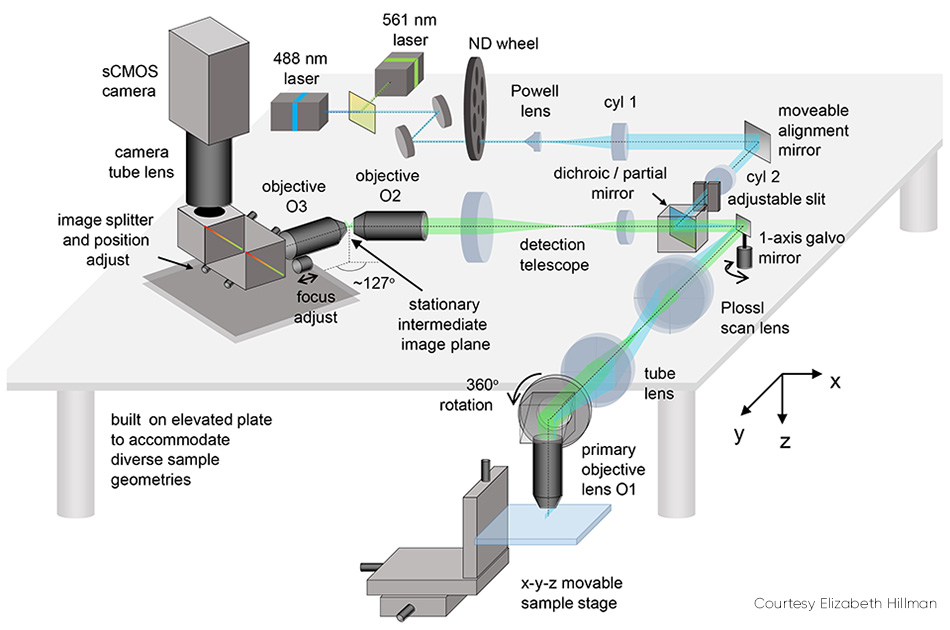
Abbildung 2: Der bewegliche Ausrichtungsspiegel ist eines der Schlüsselelemente von SCAPE 2.0.
Das endgültige Bild auf der Kamera ist eine schräge yz-Ebene aus dem Inneren der Probe, die in der Regel ein Rechteck ist. Es ist in z-Richtung (im Vergleich zu y) schmaler, da das Licht in den meisten Geweben nur begrenzt eindringen kann. Bei solchen Proben ist es sinnvoll, die Kamera so zu betreiben, dass nur eine reduzierte Anzahl von Zeilen (entsprechend der Tiefe in z) ausgelesen wird, da dies eine noch höhere Geschwindigkeit ermöglicht. So können beispielsweise 200 Zeilen mit 1.000 bis 18.000 fps ausgelesen werden, je nach verwendeter Kamera.
Das Problem der Scan-Synchronisation wurde zunächst durch das Scannen des Lichtbogens mit einem Polygonspiegel gelöst. Der Detektionspfad umfasste die Facette, die an diejenige angrenzt, die vom Anregungslicht benutzt wurde. Hillman erklärt: „Dieses Polygon war die ursprüngliche Inspiration für SCAPE, aber wir stellten bald fest, dass es einfacher und genauso effektiv war, einen einzelnen Galvanometerspiegel zu verwenden. Diese Änderung macht das System einfacher und billiger zu bauen, lässt mehr Licht zur Kamera zurück und macht es einfacher, die Scanmuster des Systems zu steuern.“
Da es außer dem Galvospiegel keine beweglichen Teile gibt, wird die Gesamtgeschwindigkeit von SCAPE nur durch die Bildwiederholrate der Kamera und das Signal-Rausch-Verhältnis (SNR) begrenzt. Je nach Experiment wird der Galvospiegel mit einer Frequenz zwischen 10 und 100 Hz abgetastet, was einer beispiellosen Geschwindigkeit von 10–100 Volumina pro Sekunde (vps) entspricht. SCAPE verwendet ein herkömmliches Sägezahn-Scanmuster, d. h. einen linearen Sweep, gefolgt von einem nahezu sofortigen Reset. Die Amplitude des Galvo-Sweeps und die Anzahl der Kamerabilder pro Sweep bestimmen das Sichtfeld des Systems und die Abtastdichte in x-Richtung. Schnellere Kameras können genutzt werden, um die Volumenraten, die Abtastdichte oder das Sichtfeld zu erhöhen. Während die meisten Aufnahmen des Teams mit Standard-sCMOS-Kameras gemacht wurden, erreichten sie mit einer Ultrafast CMOS-Kamera mit integriertem Verstärker über 300 Bilder pro Sekunde.
Da das Lichtblatt in einem Winkel zur Bildbetrachtungsachse z überstrichen wird, ist jede Tiefenschicht gegenüber der nächsten Schicht leicht versetzt. Der Computer des Mikroskops verwendet eine einfache Transformation, um diese „Schieflage“ zu korrigieren und ein unverzerrtes 3D-Bildvolumen zu erzeugen.
Digitale Lasermodulation
Die gleichzeitige Überwachung mehrerer Fluorophore, einschließlich funktioneller Indikatoren und fluoreszierender Proteine, ermöglicht die Korrelation von dynamischem Verhalten (z. B. Muskelbewegungen) mit der molekularen Zusammensetzung, der Zellstruktur, neuronalen Signalen usw. SCAPE unterstützt solche Anwendungen, indem es eine Mehrwellenlängenanregung durch optisch gepumpte Halbleiterlaser (OPSLs) von Coherent OBIS (Plug-and-Play) mit der Option bietet, gleichzeitig zwei oder mehr spektral getrennte Bilder nebeneinander auf der Kamera aufzunehmen.
Hillman führt für diese Arbeit mehrere innovative Vorteile der OPSL-Technologie im Vergleich zu früheren Lasertypen an. Sie verweist auf das breite Spektrum der verfügbaren Wellenlängen und Leistungsstufen. „Vor Jahren hatten wir 488 nm, 532 nm und 638 nm, und das war alles, wenn man eine nutzbare Leistung haben wollte. Wir hatten keine Optionen in Gelb und Orange. Aber heute können wir Laserquellen mit zehn und hundert Milliwatt bei Wellenlängen wählen, die der Anregung von fast jedem handelsüblichen Fluorophor entsprechen.“ Sie erklärt, dass die meisten ihrer SCAPE-Systeme mehrere Freiraumlaser integrieren, was ihnen mehr Flexibilität als die Faserkopplung verleiht. „Es ist sehr praktisch, dass die Laser kompakt sind und alle denselben Formfaktor und dieselbe elektronische Schnittstelle haben.“ Bis heute, sagt Hillman, haben sie in einigen Experimenten bis zu fünf Laserwellenlängen verwendet. Sie erklärt auch, dass sie SCAPE regelmäßig zu Workshops und Kursen mitnimmt und die verfügbaren OBIS-Laser mit minimaler Neuausrichtung verwendet.
Die digitale Bildgebung ist ein weiteres wichtiges Merkmal der OPSLs. Da die OPSLs mit einer Geschwindigkeit von bis zu 25 kHz ein- und ausgeschaltet werden können, kann die Anregungswellenlänge in aufeinanderfolgenden Bildern mit präzisem Timing gewechselt werden. Ergänzt wird dies durch eine Multiwellenlängen-Detektion mit einem im Labor gebauten Bildteiler, der aus dichroitischen Filtern und Spiegeln besteht. Dieses Gerät projiziert die spektral getrennten Bilder mit Sichtfeldern von bis zu 1.280 Voxeln Breite, ohne Auswirkungen auf die Bildgebungsgeschwindigkeit im Vergleich zum Betrieb mit nur einer Wellenlänge.
Präsentation von Leistung und Reichweite
Zwei kürzlich durchgeführte gemeinsame Studien veranschaulichen die Leistungsfähigkeit und Reichweite von SCAPE.
Die Bildgebung von kleinen Organismen — einschließlich des gesamten Körpers, des Gehirns und des Nervensystems - ist ein Trend in der Neurowissenschaft. Hillman und Kollegen haben kürzlich eine Studie veröffentlicht, in der sie die Hochgeschwindigkeits-3D-Bildgebung von genetisch kodierten und kalziumempfindlichen fluoreszierenden Proteinen in lebenden Drosophila-Larven beschreiben (siehe Abb. 3). Zusätzlich zur Erfassung der komplexen Dynamik des Körpers und des Nervensystems der Larve während des peristaltischen Kriechens verfolgte das Team, wie die Neuronen entlang der Körperwand feuerten, wenn sie verformt wurden.
Das Team verwendete SCAPE auch zur Untersuchung des dynamischen Feuerns neuronaler Dendriten im lebenden Kortex von Nagetieren 5 und der olfaktorischen Sinneszellen in der Nase von Mäusen 6 sowie zur Abbildung ganzer, sich frei bewegender C. elegans-Würmer. Darüber hinaus produzierten sie dramatische Videos von schlagenden, embryonalen Zebrafischherzen. 2
Studien des embryonalen Zebrafischherzens können Einblicke in die Entwicklung des Herzens von Wirbeltieren geben, einschließlich des Einflusses von genetischen und umweltbedingten Faktoren auf Struktur und Funktion. Die herkömmliche Mikroskopie erfordert ein Time Gating, das bei der natürlichen Herzfrequenz von 2 bis 4 Hz unweigerlich Details wie unregelmäßige Herzrhythmusstörungen übersehen lässt, und sie kann keine vollständige 4D-Partikelverfolgung für die Analyse des Flusses der roten Blutkörperchen (RBC) durchführen. Hillmans Team arbeitete mit der Kinderkardiologin Professor Kimara Targoff zusammen, deren Labor Zebrafische verwendet, um genetische Mutationen zu entschlüsseln, die Herzfehlbildungen beim Embryo verursachen können. Im Rahmen der Zusammenarbeit wurden Videos von roten Blutkörperchen aufgenommen, die mit mehr als 100 Bildern pro Sekunde durch das schlagende Herz strömen, und die GCaMP-Markierung genutzt, um einzelne Wellen der Kalziumaktivität zu erfassen, die durch das schlagende Herz strömen (siehe Abb. 4).
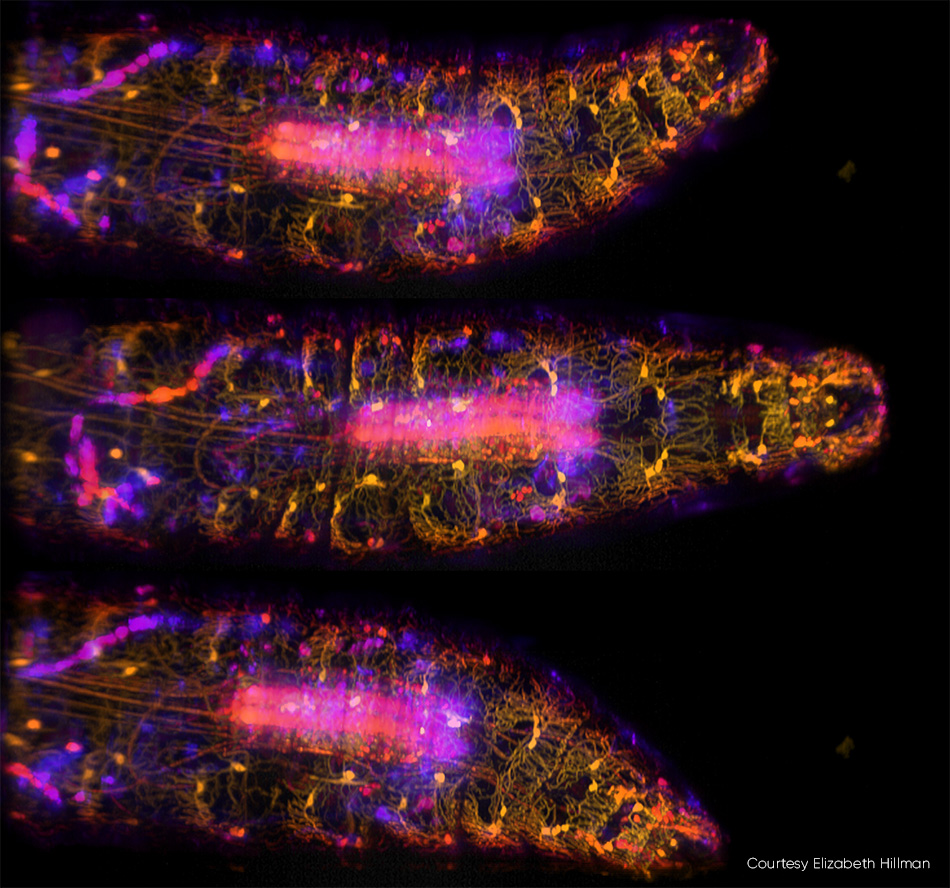
Abbildung 3: In diesen drei Bildern einer sich bewegenden Drosophila-Larve, die mit SCAPE 2.0 bei 10 vps [3] aufgenommen wurden, sind ventrale propriozeptive Neuronen mit GFP markiert und mit 488 nm Anregung abgebildet. Die Farben (von gelb bis blau) kennzeichnen Signale aus verschiedenen Tiefen der Probe. Ausführliche Informationen finden Sie bei R. Vaadia et al. [4] und eine Echtzeit-Videosequenz aus dieser Studie finden Sie unter http://bit.ly/SCAPE2019.
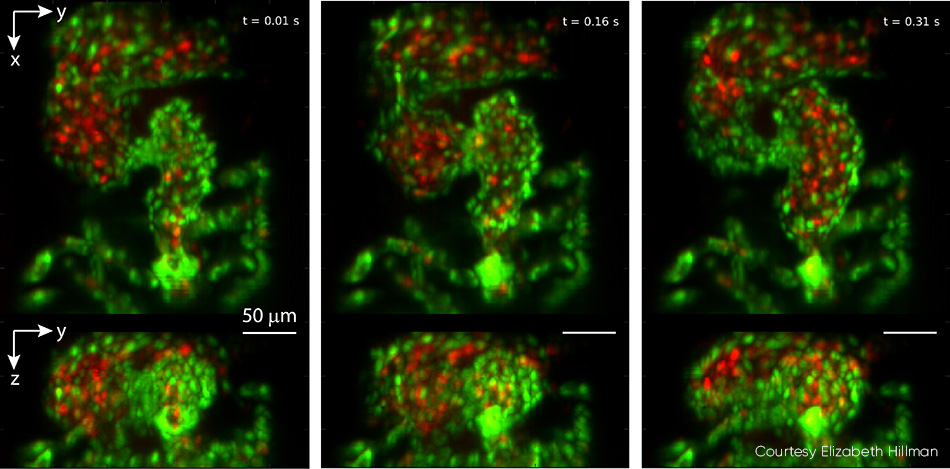
Abbildung 4: Dieses Triptychon stammt aus einem Video, das das Herz eines Zebrafisches in Echtzeit zeigt und mit 100 vps aufgenommen wurde. Die oberen Felder zeigen die Z-Projektion und die unteren Felder die X-Projektion. Der Ventrikel des Herzens beginnt komprimiert, wobei die Ausflussklappe geöffnet ist, und füllt sich dann in aufeinanderfolgenden Bildern aus dem Vorhof. Die Endothelzellen der Herzwand sind mit EGFP (grün) markiert. Die roten Blutkörperchen sind mit DsRed (rot) markiert). Beide Fluorophore wurden mit 488 nm Laserlicht (0,6 mW an der Probe) angeregt). Alle Einzelheiten, einschließlich Video, finden Sie unter V. Voleti et al. [2]
Zusammenfassung
In den Biowissenschaften wird die Fluoreszenzmikroskopie als Instrument eingesetzt, das es Forschern ermöglicht, Ereignisse auf molekularer, zellulärer, organischer und organismischer Ebene miteinander zu verbinden. Die Fähigkeit, hochauflösende 3D-Bilder in lebensnaher Geschwindigkeit aufzunehmen — die 4D-Mikroskopie — wird nun eine Schlüsselrolle bei der Beschleunigung dieser Forschung spielen.
Referenzen
REFERENZEN
1. M. B. Bouchard et al., Nat. Photonics, 9, 2, 113–119 (2015).
2. V. Voleti et al., Nat. Methods, 16, 10, 1054–1062 (2019).
3. C. Dunsby, Opt. Express, 16, 25, 20306–20316 (2008).
4. R. Vaadia et al., bioRxiv, 467274 (2018).
5. E. M. Hillman et al., Curr. Opin. Neurobiol., 50, 190–200 (2018).
6. L. Xu et al., Science, 368, 6487, eaaz5390 (2020).