기사
삶의 속도에 맞는 고해상도 다색 3D 이미징
스윕 공초점 정렬 평면 여기(SCAPE) 현미경인 혁신적인 레이저 형광 기술은
이전 방법의 한계를 극복하고 광범위한 생명 과학 분야에 활용할 수 있습니다.
개요
다양한 생명과학 분야의 연구원들은 고속, 높은 픽셀 수 및 단일 세포 해상도가 특징이고 표본에 심각한 광손상을 일으키지 않고 이미지를 획득할 수 있는 3D 형광 현미경 도구를 공통적으로 필요로 합니다. 수많은 개발과 기술이 개선되었음에도 확립된 대부분의 기술에는 여전히 이러한 매개변수 중 하나 이상에 타협하는 절충안이 수반됩니다.
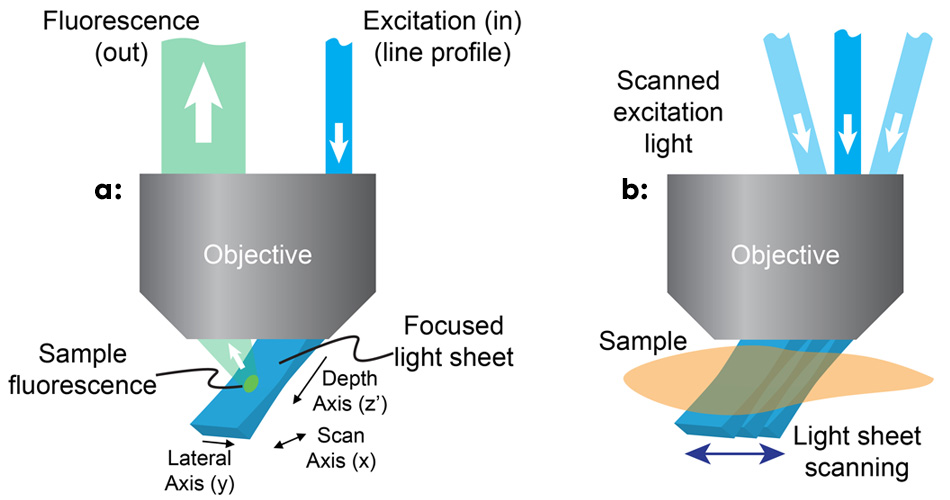
그림 1: SCAPE에서 단면광은 라인 프로파일 빔을 이용한 기본 현미경 대물 렌즈의 축외 조명에 의해 비스듬한 각도로 형성됩니다(a). SCAPE는 이어지는 조명된 평면 이미지를 캡처하는 동안 단면광을 스캔하여 체적 이미지를 만듭니다(b).
진행 상황과 절충안
예를 들어 공초점 현미경은 물리적으로 단일 지점을 스캔하는 속도의 제한으로 인해 다중 헤르츠 반복률로 고해상도의 큰 xyz 볼륨을 이미지화할 수 없습니다. 게다가 픽셀당 체류 시간이 짧아 가장 빠른 공초점 스캔에서 높은 레이저 출력이 필요하며, 결과적으로 라이브 샘플에 상당한 광손상이 발생합니다.
이광자 현미경은 광손상을 대폭 줄이기는 하나, 이러한 단일 지점 접근 방식을 사용하다 보면 속도/해상도/체적 절충점으로 인한 동일한 문제에 직면하게 됩니다. 최근에 개발된 고속 음향 광학 변조기(AOM)를 사용하면 미리 선택된 작은 부피를 이제 더 빠르게 스캔할 수 있지만 이 접근 방식은 큰 부피 또는 움직이는 유기체에 제한적으로 사용됩니다.
기존의 단면광 현미경으로 전체 xy 평면을 동시에 샘플링할 수 있지만, 3D 데이터 큐브를 구축하기 위해 측면 샘플 접근(이에 따른 특별한 준비)과 시간이 필요합니다. 또한 광학과 스테이지 움직임의 동기화로 인해 이러한 기술이 복잡하고 느려집니다.
컬럼비아 대학교 Zuckerman Mind Brain Behavior Institute(뉴욕주 뉴욕)의 Elizabeth Hillman 교수와 동료들은 다양한 장착 및 비장착 샘플 형상을 지원하면서 이러한 제한을 없애는 혁신적인 접근 방식을 개발하기 시작했습니다. 이들은 2015년 간행물에서 처음 기술된 공초점 정렬 평면 여기(SCAPE) 현미경이라는 성공적인 결과를 내게 되었습니다. 1 2019년에는 업데이트 버전인 SCAPE 2.0이 보고되었고,2 Leica Microsystems는 광범위한 생명과학 유틸리티를 인식하여 이를 허가했습니다.
SCAPE 작동 방식
Hillman은 다음과 같이 설명합니다. “우리는 속도가 매우 빠른 이미징이 단일 또는 다중 지점 스캐닝에서 나올 수 없다고 추론했습니다. 필요한 스캔 속도를 얻을 수 있더라도 각 픽셀의 체류 시간은 허용되는 신호 대 잡음비로 이미지를 얻기에는 너무 짧습니다. 그래서 우리는 단면광 현미경에 대해 생각하기 시작했습니다. 그 당시 거의 모든 시스템에는 샘플 주위에서 서로 90°로 배치된 두 개의 대물렌즈가 필요했습니다. 따라서 문제는 단면광의 다중 픽셀 이점을 단일 대물렌즈 구성에 결합할 수 있는지 여부가 되었습니다.”
연구팀은 축외 경로를 사용하면 높은 수치의 조리개 대물렌즈의 가장자리를 통해 현미경의 실제 xy 평면과 45°를 이루는 여기 단면광을 만들 수 있다는 것을 알아냈습니다(그림 1 참조). 이 사면에서 나오는 형광을 이미지화하기 위해 사면 현미경과 유사한 접근 방식으로 대물 렌즈의 이미징 면을 회전하여 카메라 초점을 정확하게 맞추었습니다.3 Hillman과 그의 팀은 대물 렌즈 상부의 스캐닝 미러를 사용하여 단면광을 좌우로 움직이고, 이로 인해 돌아오는 형광 광원의 방향이 바뀌어 이동하는 단면광에 대한 초점을 유지합니다. 현미경은 미러가 움직일 때 평면을 쌓음으로써 3D 볼륨의 이미지를 빠르고 반복적으로 생성할 수 있습니다.
SCAPE 2.0(그림 2 참조)의 장점 설명. 경사면(즉, 시야 축에 대해 어떤 각도를 이루는 단면광)을 이미징하는 문제는 캡처된 형광을 전달하여 두 번째 대물 렌즈로 중간 지점에서 실제 경사 이미지를 형성함으로써 해결됩니다. 그런 다음 비스듬히(약 127°로) 배열된 두 번째 대물 렌즈를 통해 이 이미지를 캡처하여 단면광 평면의 초점을 카메라에 평평하게 맞춥니다.
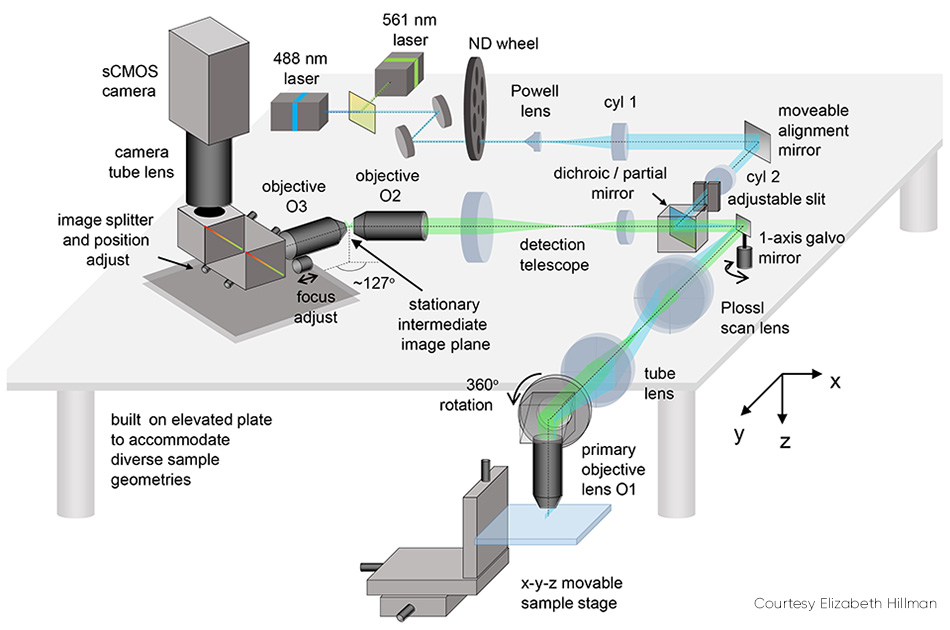
그림 2: 이동식 정렬 미러는 SCOPE 2.0의 핵심 요소 중 하나입니다.
카메라의 최종 이미지는 샘플 내에서 비스듬한 yz 평면으로, 일반적으로 직사각형입니다. 대부분의 조직에 빛이 제한적으로 침투하기 때문에 z 방향(y에 비해)이 더 좁습니다. 이러한 샘플에서는 훨씬 더 빠른 이미징이 가능하기 때문에 감소된 행 수(z의 깊이에 해당)만 판독하도록 카메라를 작동하는 것이 유용합니다. 예를 들어 사용하는 카메라에 따라 1,000~18,000fps에서 200행을 판독할 수 있습니다.
스캔 동기화 문제는 먼저 폴리곤 미러를 사용하여 단면광을 스캔함으로써 해결되었습니다. 검출 경로에는 여기 광에 의해 사용된 것에 인접한 패싯을 포함되었습니다. Hillman은 다음과 같이 설명합니다. “이 폴리곤 미러는 SCAPE에 대한 영감의 원천이었지만 단일 검류계 미러를 사용하는 것이 더 간단하고 효과적이라는 것을 곧 깨달았습니다. 이 변경 사항으로 인해 시스템을 더 쉽고 저렴하게 구축할 수 있으며, 카메라에 더 많은 빛을 반환하고 시스템의 스캔 패턴을 더 쉽게 제어할 수 있습니다.”
검류계 미러 외에 움직이는 부분이 없기 때문에 SCAPE의 전체 속도는 카메라 프레임 속도와 신호 대 잡음비(SNR)에 의해서만 제한됩니다. 특정 실험에 따라 검류계 미러는 10~100Hz에서 스캔되며, 이는 전례 없는 10~100vps(초당 볼륨)에 해당합니다. SCAPE는 기존의 톱니 스캔 패턴, 즉 선형 스위프 후 거의 즉각적인 재설정을 사용합니다. 검류계 스위프의 진폭과 스위프당 카메라 프레임 수는 x 방향에서 시스템의 시야와 샘플링 밀도를 결정합니다. 더 빠른 카메라를 활용하여 볼륨 속도, 샘플링 밀도 또는 시야 범위를 높일 수 있습니다. 팀은 대부분의 이미징에서는 표준 sCMOS 카메라를 사용했지만 통합 강화기가 있는 초고속 CMOS 카메라를 사용하여 300vps 이상의 이미징에 도달했습니다.
단면광이 이미지 보기 축 z에 대해 비스듬히 주사되기 때문에 각 깊이 슬라이스는 다음 슬라이스를 기준으로 약간 오프셋됩니다. 현미경의 컴퓨터는 이 '왜곡'을 수정하고 왜곡되지 않은 3D 이미지 볼륨을 생성하기 위해 간단한 변환을 사용합니다.
디지털 레이저 변조
기능 지표 및 형광 단백질을 포함하여 여러 형광단을 동시 모니터링하면 동적 거동(예: 근육 활동)과 분자 구성, 세포 구조, 신경 신호 등의 상관 관계를 입증할 수 있습니다. SCAPE는 플러그 앤 플레이 Coherent OBIS 광여기 반도체 레이저(OPSL)를 통해 다중 파장 여기를 제공하고 카메라에서 나란히 두 개 이상의 스펙트럼으로 분리된 이미지를 동시에 획득할 수 있는 옵션을 제공하여 이러한 응용 분야를 쉽게 지원합니다.
Hillman은 이전 레이저 유형과 비교하여 이 작업에서 광여기 반도체 레이저 기술의 몇 가지 혁신적인 이점을 인용합니다. 사용 가능한 파장과 전력 수준의 넓은 범위에 주목합니다. “몇 년 전에 저희는 488nm, 532nm, 638nm를 가지고 있었고 사용 가능한 전력 수준을 원했다면 그것으로 충분했습니다. 노란색과 주황색 옵션이 없었습니다. 그러나 오늘날에는 일반적으로 사용 가능한 거의 모든 형광단의 여기와 거의 일치하는 파장에서 수십 및 수백 밀리와트의 레이저 소스를 선택할 수 있습니다.” Hillman은 대부분의 SCAPE 시스템이 여러 자유 공간 레이저를 통합하여 파이버 결합보다 더 많은 유연성을 제공한다고 설명합니다. “레이저가 컴팩트하고 모두 동일한 폼 팩터와 동일한 전자 인터페이스를 가지고 있다는 것이 매우 편리합니다.” 현재까지 Hillman은 일부 실험에서 최대 5개의 레이저 파장을 사용했다고 말합니다. 또한 SCAPE를 워크샵과 강좌에 정기적으로 가지고 가고 최소한의 재정렬을 통해 사용 가능한 OBIS 레이저를 사용한다고 설명합니다.
디지털 이미징은 광여기 반도체 레이저의 또 다른 중요한 기능입니다. OPSL(광여기 반도체 레이저)은 최대 25kHz의 속도로 켜고 끌 수 있기 때문에 정확한 타이밍으로 연속 프레임에서 여기 파장이 교번될 수 있습니다. 이는 이색 필터 및 미러로 구성된 실험실 구축 이미지 스플리터를 사용하는 다중 파장 감지로 보완됩니다. 이 장치는 단일 파장 작업과 비교하여 이미징 속도에 영향을 미치지 않으면서 최대 1,280복셀 너비의 시야로 스펙트럼으로 분리된 이미지를 투사합니다.
출력 및 범위 시연
두 개의 최근 공동 연구는 SCAPE의 출력과 범위를 보여 줍니다.
몸 전체, 뇌 및 신경계를 포함한 작은 유기체의 이미징은 신경 과학의 추세입니다. 최근에 Hillman과 동료들은 살아 있는 초파리 유충에서 유전체를 인코딩한, 칼슘에 민감한 형광 단백질을 고속 3D 영상 촬영 기법으로 촬영하는 방법을 설명하는 연구를 발표했습니다. 팀은 연동 크롤링 동안 유충의 몸과 신경계의 복잡한 역학을 포착하는 것 외에도 체벽을 따라 변형된 뉴런이 어떻게 발화하는지 추적했습니다.
또한 팀은 SCAPE를 사용하여 살아있는 설치류 피질5의 뉴런 수상돌기 및 쥐 코에 있는 후각 감각 뉴런6을 연구하고 자유롭게 움직이는 예쁜꼬마선충 전체를 이미지화했습니다. 게다가 제브라피쉬 배아의 심장 박동에 대한 극적인 비디오를 제작했습니다.2
제브라피쉬 배아의 심장에 대한 연구는 유전적 및 환경적 요인이 구조와 기능에 미치는 영향을 포함하여 척추동물의 심장 발달에 대한 통찰력을 제공할 수 있습니다. 기존의 현미경은 2~4Hz의 자연 심박수를 고려할 때 불규칙한 부정맥과 같은 세부 사항을 불가피하게 놓치는 시간 게이팅이 필요하며, 적혈구(RBC) 흐름 분석을 위한 전체 4D 입자 추적을 수행할 수 없습니다. Hillman의 팀은 제브라피시를 사용하여 배아에서 심장 기형을 유발할 수 있는 유전적 돌연변이를 해독하는 연구실의 소아 심장 전문의 Kimara Targoff 교수와 협력했습니다. 이들은 함께 100 vps 이상으로 심장이 뛸 때 적혈구의 흐름을 동영상으로 촬영하고 GCaMP 표지를 활용해 심장이 뛸 때 칼슘 활동의 각 흐름을 촬영했습니다(그림 4 참조).
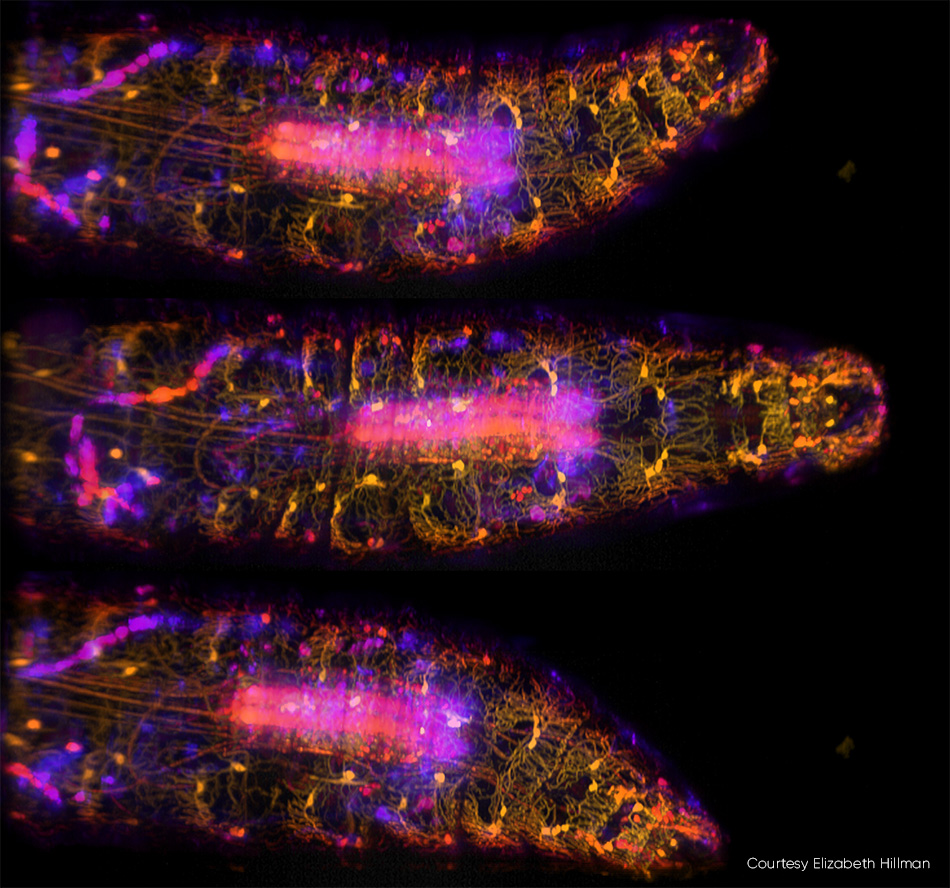
그림 3: vps에서 SCAPE 2.0으로 캡처한 움직이는 초파리 유충의 이 세 이미지에서 [3] 복부 고유수용성 뉴런은 GFP로 표시되고 488nm 여기를 사용하여 이미지화됩니다. 색상(노란색에서 파란색까지)은 샘플에 대한 다양한 깊이의 신호를 나타냅니다. 자세한 내용은 R. Vaadia et al.[4]에서 확인하고, 이 연구의 실시간 동영상 시퀀스는 http://bit.ly/SCAPE2019에서 확인할 수 있습니다.
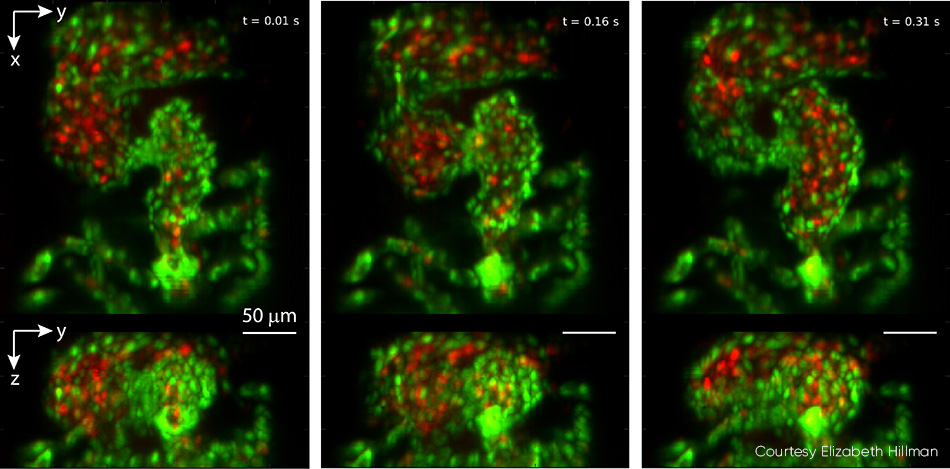
그림 4: 실시간으로 제브라피시의 심장이 뛰는 모습을 보여 주는 영상에서 가져온 이 삼면화는 100vps에서 캡처되었습니다. 상단 패널은 z 투사를 보여 주고 하단 패널은 x 투사를 보여 줍니다. 심장의 심실은 유출 밸브가 열린 상태에서 압축을 시작한 다음 연속된 이미지에서 심방으로부터 채워집니다. 심장벽의 내피 세포는 EGFP(녹색)로 표시되고 적혈구는 DsRed(빨간색)로 표시됩니다. 두 형광단은 488nm 레이저 광(샘플에서 0.6mW)으로 여기되었습니다. 비디오를 포함한 자세한 내용은 V. Voleti et al. [2]을 참조하십시오.
요약
생명과학 전반에 걸쳐 형광 현미경은 연구원들이 분자, 세포, 기관 및 유기체 수준에서 사건을 연결할 수 있게 해 주는 도구로 사용됩니다. 고해상도 다색(3D) 이미지를 삶의 속도에 맞춰 기록하는 기능(4D 현미경)은 이제 이 연구를 가속화하는 데 중요한 역할을 할 것입니다.
참고 문헌
참고 문헌
1. M. B. Bouchard et al., Nat. Photonics, 9, 2, 113–119 (2015).
2. V. Voleti et al., Nat. Methods, 16, 10, 1054–1062 (2019).
3. C. Dunsby, Opt. Express, 16, 25, 20306–20316 (2008).
4. R. Vaadia et al., bioRxiv, 467274 (2018).
5. E. M. Hillman et al., Curr. Opin. Neurobiol., 50, 190–200 (2018).
6 L. Xu et al., Science, 368, 6487, eaaz5390 (2020).