ホワイトペーパー
THz-Raman分光の概要
概要
テラヘルツ(THz)は、0.15 THz~6 THz(5 cm-1 ~200 cm-1)程度の電磁波領域で、古くから物質の低エネルギー振動モードを調べる手段として研究されてきました。 この領域は、結晶内の分子間振動を研究する分光学者にとって特に魅力的であり[1]、材料の多くの重要な特性を支配する分子配向に関する重要な情報を得ることができます。 最も基本的なレベルでは、THz分光は遠赤外線(FIR)吸収分光の延長線上にあります。 実際には、光周波数領域の極端なローエンドと、エレクトロニクス用の周波数領域の極端なハイエンドに位置するため、実装ははるかに困難です。 そのため、このスペクトルの領域は、発表された文献ではしばしば「テラヘルツギャップ」と呼ばれます[2]。 現在、市販のTHz分光装置が販売されていますが、THz波の発生に通常必要とされるウルトラファーストレーザの複雑さや、試料の湿度に対する感受性のため、そのほとんどが非常に高価で使いにくいものとなっています。
幸い、テラヘルツ波を直接吸収するだけでなく、テラヘルツ領域の振動モードの多くはラマン活性を持つため、THz領域の振動モードにアクセスする唯一の方法です。 ラマン散乱は、光子の非弾性散乱であり、吸収ではないため、励起波長と調査対象の振動モードは切り離されます。 従来のラマンでは、200 cm-1~1800 cm-1という周波数帯が「化学指紋」と呼ばれ、分子内の振動の多くがこの周波数帯で発生しているため、この周波数帯のスペクトルが使用されます。 5 cm-1~200 cm-1までのTHz-Raman™(低周波ラマン、LFRとも呼ばれる)領域は、主に材料の分子間振動や格子/フォノンモードに対応する「構造指紋」を提供するものです。 図1は、THz分光(50 μm~2 mm)、赤外分光(5~50 μm)、THz-Raman分光が電磁波スペクトル内で発生する波長位置を相対的に示したものです。 図2は、典型的なラマンスペクトルの化学的および構造的フィンガープリントの相対的な位置を示しています。
非弾性散乱(ラマンシフト)は弾性散乱(レイリー)よりも数段弱いため、レイリー散乱を適切にフィルタリングすることが困難であり、これまでTHz領域でのラマン分光の実現は困難でした。 そのため、レイリー線(0 cm-1)に非常に近いラマンシフトのシグナルを分離することが困難でした。 この状況は、体積ホログラフィックノッチフィルターの革新的な開発により、高い光学効率を持つシンプルなモノクロメーターだけで、5 cm-1のラマンシフトを直接測定することが容易になったことで一変しました[3]。 このブレークスルーは、低周波ラマンにパラダイムシフトをもたらす結果となりました。 複雑な多段式モノクロメーターを必要とする比較的新しいものから、科学者なら誰でも数分でセットアップできる自己完結型の分光器、さらに既存の装置用のプラグアンドプレイアドオンモジュールまで、さまざまなものがあります。 たとえば、反応モニタリング用の液浸プローブ、試料の位相をマッピングする顕微鏡プラットフォーム、高スループット検査アプリケーション用のウェルプレートリーダーなどが、このテラマンモジュールに含まれます。
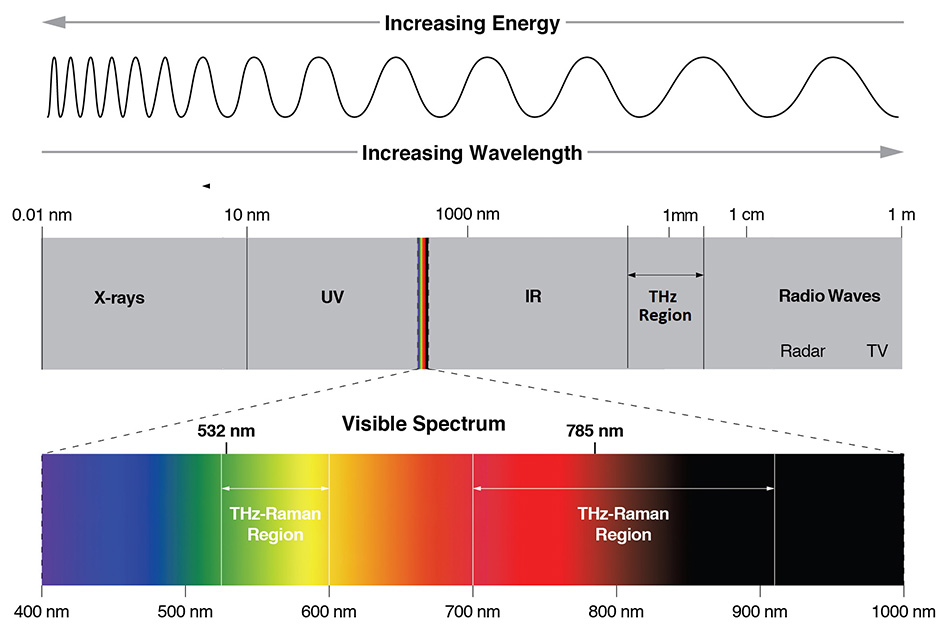
図1: 様々な分光技術の位置を示す電磁波スペクトル。ラマン分光は通常、可視光(532 nm)または近赤外線(785 nm)で行われ、赤外線吸収分光は5~50 μm、THz分光は50 μm~2 mmで行われます。
THz-Ramanシステム要件
一般に、すべてのTHz-Ramanシステムには次の4つの要素があります。
- 波長安定化レーザソース
- 狭帯域(< 5 cm-1)スペクトルクリーンアップフィルター
- 狭帯域(< 5 cm-1)レイリー散乱ブロッキングフィルター
- 低周波信号を検出することができる分光器
レイリーフィルタ(帯域幅±5 cm1のノッチフィルタ)は、システムがTHz領域のどこまで検出できるかを制限する要因になるはずです。 しかし、レイリーフィルターが正しく機能するためには、レーザの出力スペクトルが極めて安定していること、線幅が非常に狭いこと、ノッチフィルターの透過領域内で増幅自然放出(ASE)やサイドバンドによるノイズが極めて小さいことが重要です。 また、レイリー信号の漏れや分光器の飽和を防ぐために、フィルターとレーザの中心波長を互いに「分光同期」させることが重要です。 レーザ、フィルター、光学システムの総合メーカーとして、Coherentの分光器とモジュールはすべてこの同期を完璧に保つように設計されており、常に堅牢で操作性の良い性能を保証しています。
さらに、ラマンスペクトルはレーザ周波数からの相対的なシフトとして測定されるため、THz-Ramanシステムでは、可視または近赤外(NIR)の任意の波長のレーザを使用して、これらの低エネルギー振動モードをプローブできるため、THzレーザ源が必要ないことも利点の1つです。 これにより、ガラス光学系やファイバー、コンパクトで安価な半導体レーザや半導体レーザ励起固体(LD励起固体レーザ)レーザ光源、シリコン検出器や検出器アレイを使用した、よりシンプルで安価な分光収集方式が可能になりました。 また、THz-Ramanシステムは、-5 cm-1以下のアンチストークスラマンシフトを検出することができ、局所有効温度などの試料に関する追加情報を提供することができる。 したがって、THz-Ramanシステムは、1回の測定で材料の化学的指紋と構造的指紋の両方を高いスループットで同時に測定することができます。
THz分光情報の利点とラマン分光の使いやすさを組み合わせることで、現在では、材料の化学的特性と構造的特性の両方に関心を持つアプリケーションのための強力なソリューションとなっています。 THz-Ramanは製薬業界[4-9]で急速に採用されつつあり、ポリマー[10]、半導体[11-13]、生物医療診断[14]でも注目されています。
低周波振動モード
前述したように、低周波のピークはフォノンモードや格子振動などの分子間振動に起因します。 結晶の試料では、ピークの位置(シフト)は、結晶の組成(化学的、構造的)詳細に固有です。 そして、この鋭い低周波ピークの帯域幅と強度は、試料の構造(結晶性)の度合いに直接関係します。 一方、アモルファス固体や液体には、ボソンピークと呼ばれる広い未分離のピークが存在しまる。 したがって、THz-Raman分光スペクトルは、試料の結晶性を定量的に分析し、異なる同位体や多形を分類するための有用なツールです。 多形体解析の方が一般的ですが、低周波の振動モードの特性をよりよく説明するためには、異なる同素体のTHz-Ramanスペクトルを調べるとわかりやすいでしょう。
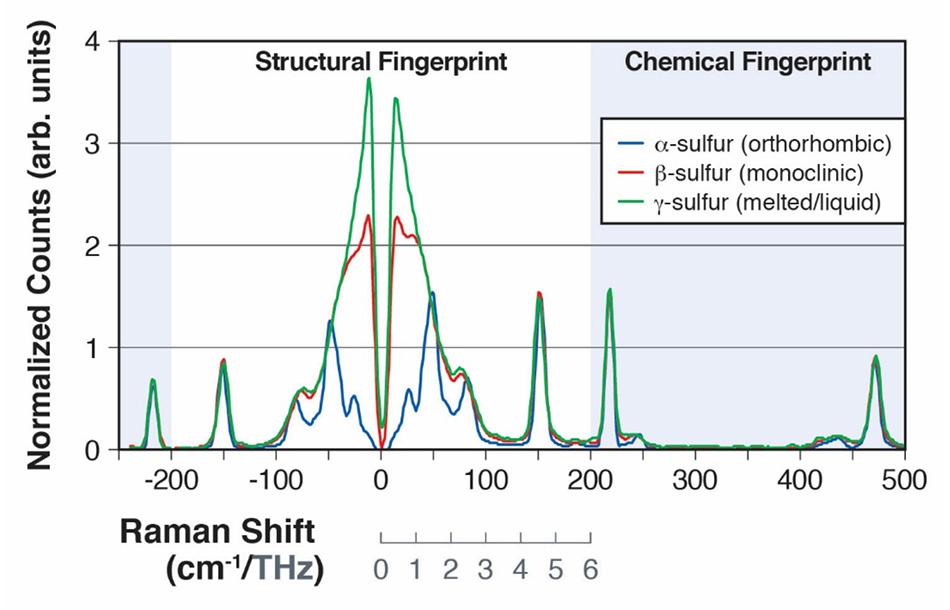
図2: α-硫黄とβ-硫黄のラマンスペクトル。200 cm-1の分子間振動モード(A)と200 cm-1〜500 cm-1の分子内振動モード(B)を示しています。
30以上の同素体を持つ硫黄は、ライフサイエンスと産業応用の両方で幅広い化学加工方法において重要であることから、広範囲にわたって研究されています[15]。同素体のα-硫黄は24種類の分子間振動を持ち、その多くが30 cm-1 - 100 cm-1領域のスペクトルでラマン活性を示すことが示されています[16]。2013年のSPIE Defense, Security, and Sensingカンファレンスで発表された論文で、Heylerらは、これらの振動モードをTHz-Ramanを使って検出する方法を示しました[3]。さらに、α-硫黄の試料を95.6℃以上に加熱すると、同素体であるβ-硫黄に形状変化し、115.2℃で液化することを明らかにしました。α型(斜方晶)から低秩序β型(単斜晶)への遷移は、乱れの増大により100 cm-1以下のラマン分光のモードが「ぼやけ」、よりボゾンピーク構造に近づいていることから容易に検出できました[図2]。融解してy型(液体)になると、THz-Raman領域の構造モードは完全に融合し、通常の液体に典型的な純粋なボソンバンドのみを示すようになります[17]。一方、化学指紋領域のモードは、100 cm-1以上のスペクトルのピーク位置を比較すると明らかなように、形状変化の影響をあまり受けていないことがわかりました。図2のスペクトルはすべて、正立顕微鏡とファイバー結合型分光器に取り付けられたCoherent TR-MICRO THz-Ramanモジュールを用いて収集されたものです。図3にセットアップの模式図を示します。
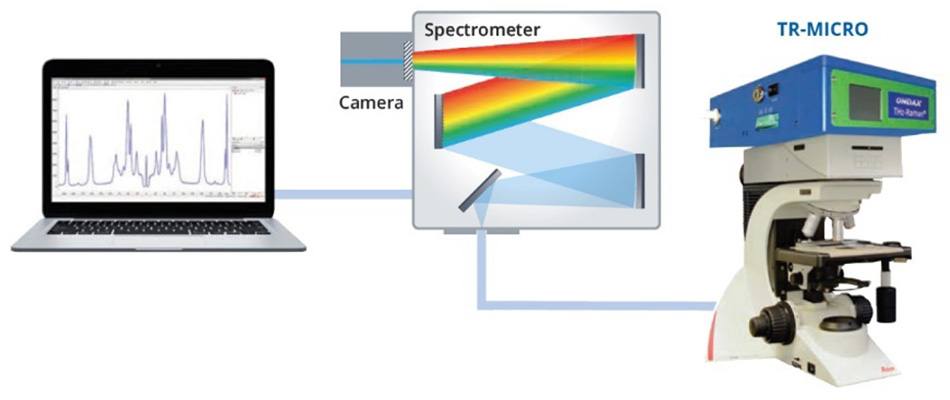
図3: α-硫黄とβ-硫黄のTHz-Ramanスペクトルを収集するために使用した実験装置の概略図。
THz-Ramanには、単一周波数の励起レーザと、超狭帯域(体積ホログラフィック)レーザラインおよびノッチフィルターが精密にマッチングされています。 ノッチフィルターは、ラマン散乱のスループットを最大限に確保しながら、光学密度(OD)9以上のレイリー散乱を減衰させるよう特別に設計されており、不均質な試料でも使用することができます。 最後に、残ったラマン散乱を光ファイバーケーブルで分光器に結合します。 光学設計の詳細な説明は、会議録[3]に掲載されています。
医薬品への応用
多形性は、医薬品有効成分(API)の重要かつ共通の特性です。 薬物のバイオアベイラビリティ、製造性、品質・性能に直接的な影響を与えます[18]。 多形化合物は、ベースとなる分子組成は同じだがバルクの構造配向が異なるため、THz-Ramanは、従来の赤外(IR)やラマン分光法よりも、多形体の決定にはるかに適しています。 なお、多形性の違いにより、分子内振動の減衰が原因で、ラマンスペクトルの化学指紋領域で微妙なピークシフトが起こる場合があることを指摘しておきます[19、20]。 とはいえ、低周波領域でのスペクトル変化ははるかに顕著で(最大10倍の強さ)、複雑な化学分析を必要とせず、より簡単に区別できる傾向があります。 さらに、LarkinらがApplied Spectroscopyに掲載された2014年の論文で示したように、「APIに典型的な大きな芳香族種の低周波ラマンスペクトルは、複雑なスペクトルの特徴を持つ200 cm-1以下の著しく強いバンドを提供する[9]。」とあります。さらに、これらのバンドは、同じ周波数帯の周囲の賦形剤のバンドよりも通常1桁以上強いため、THz-Ramanによって「結晶構造、結晶障害、非晶質状態」を高感度に直接測定することができると説明しています。

図4: Coherentのベンチトップ型THz-Ramanモジュール「TR-BENCH」。
上記の研究[9]と2015年に発表されたフォローアップ研究[10]の間に、Bristol-Myers Squibbの研究者は、いくつかの一般的な原薬の多形の低周波ラマンバンドについて詳細な分析を行いました。 この2つの論文では、インドメタシン、カルバマゼピン、カフェイン、テオフィリン、アピキサバンを分析しています。 Larkinらは、図4に示すCoherentが現在販売している TR-BENCH と同様のベンチトップ型THz-Ramanサンプリングシステムを使用しました。TR-BENCHは、前項で説明したTR-MICROと同じ内部光学系を持っています。 この研究の一例として、3種類のカルバマゼピンのTHz-Ramanスペクトルを図5に示します。
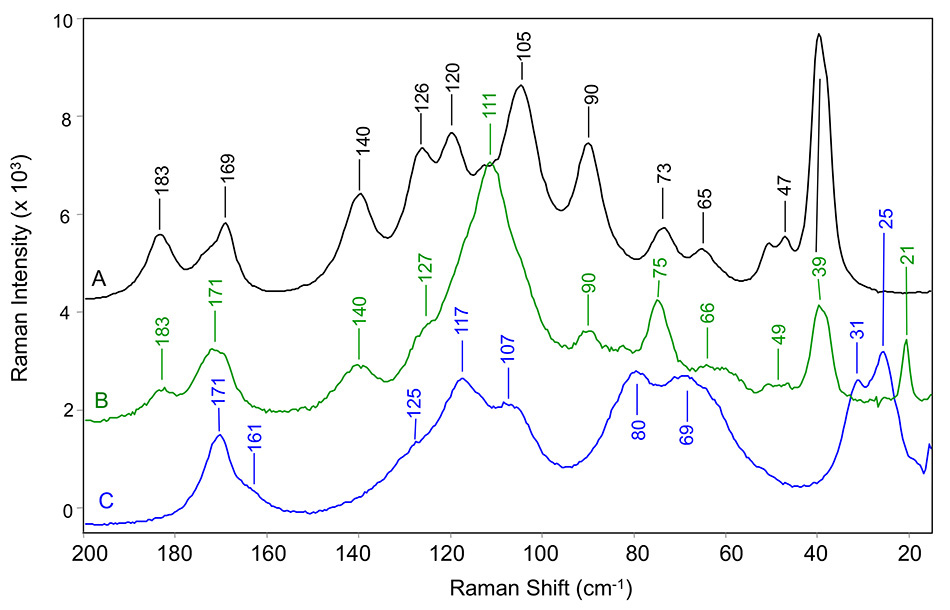
図5: カルバマゼピンの(A)III型、(B)擬似多形二水和物型、(C)II型におけるTHz Ramanスペクトル。すべて室温で測定[8]。
近年、THz-Raman分光は、研究室から、しばしば加工方法分析技術(PAT)と呼ばれる製薬加工方法監視のアプリケーションへと移行しています[21-24]。 加工方法アプリケーションでは、ファイバー結合型テラフォーマープローブにより、インライン、オンライン、アットラインでの測定が可能となり、分析装置が試料から離れた場所にあり、試料を捕獲して分析装置まで持っていく必要がないためです。 要求に応じて、アクセスポートから反応槽に直接浸漬できるようワーキングディスタンスを短く設計したり、ビューイングウィンドウからスペクトルを収集できるようワーキングディスタンスを長く設計したりすることができます。 図6は、TR-PROBEに浸漬型プローブチップを取り付けた例です。

図6: Coherent製11インチ長ステンレス製イマージョンチップが付属したTHz-RamanプローブモジュールTR-PROBE。
井上氏らは、この方法を用いて、エタノールと水の濃度を変えて、カルバマゼピンIII型からカルバマゼピン二水和物への転移を監視しました[22]。図7の結果は、カルバマゼピン二水和物(111 cm-1)とカルバマゼピンIII(39 cm-1)のTHz-Ramanバンドが支配的で、多次元曲線解決(MCR)アルゴリズムを用いて計算した場合のものです。このデータをもとに、エタノール62.5%と水37.5%の溶液を用いた反応が最も早く変換されることを突き止めました。
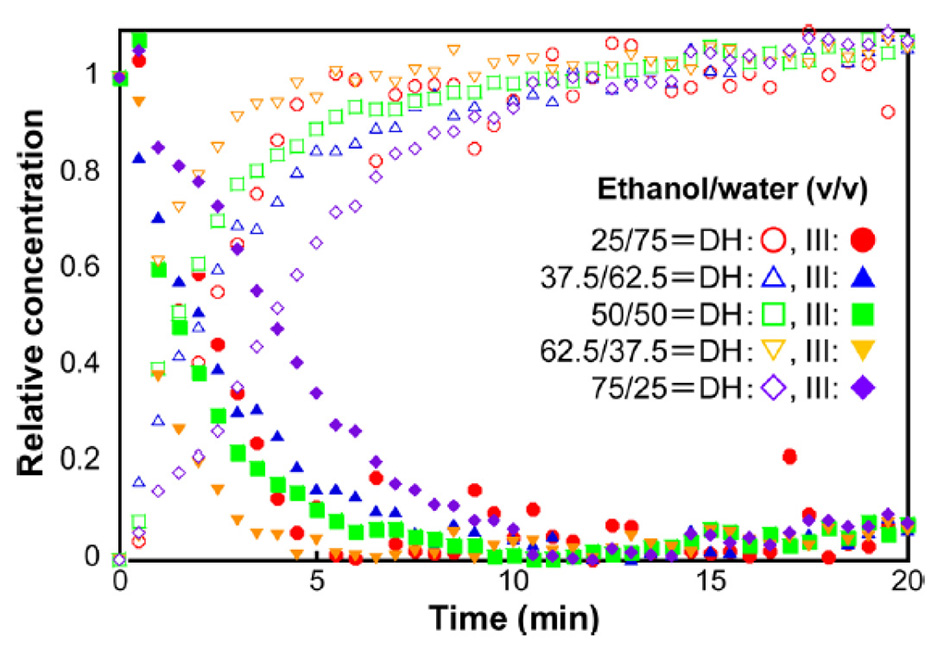
図7: エタノールと水の溶媒比率を変化させた場合のカルバマゼピンIII型からカルバマゼピン二水和物への変換の濃度キネティクス[21]。
THz-Ramanの未来
THz-Ramanが広く採用されたのは製薬業界が最初ですが、他の分野でも結晶性、多形性の分析に利用されています。 最近の例としては、有機半導体における移動度と歪みの関係[25]、電荷輸送と低周波振動[12]を調べるためにTHz-Ramanを使用したことが挙げられます。 また、量子ドット[11]や層状半導体合金[13]のフォノンモードの解析にも利用されています。 最近では、ポリマーの結晶化[10]や冷却過程でのラメラ形成[26]に関する研究も発表されており、ポリマー産業において製品の構造的特性に関する重要な情報を提供しています。 THz-Ramanの最もエキサイティングな応用分野は、おそらくバイオとバイオ医療診断でしょう。 サンフランシスコで開催された2019年のSPIE BiOS会議では、Marbleらが生体分子へのTHz-ラマンの利用について初めて講演し[14]、その1年後にはすでにTHz-RamanがCOVID-19の診断ツールとして検討されています[27]。
概要
THz-Ramanは、構造および化学組成の情報を堅牢かつ同時にユーザーに提供することが繰り返し示されてきました。 THz-Raman分析装置が研究室から産業現場へと移行するにつれて、アプリケーションはますます拡大することは間違いないでしょう。 この時点で、THz-Ramanが明らかにする差別化された情報を、まだ思いつかないような新しい使い方を研究者が見つけていくのは必然的なことです。 THz-Raman装置組込み、アプリケーション、機能についての詳細は、www.thz-raman.comまたは、弊社ウェブサイトwww.coherent.comから、アプリケーションサイエンティストへのコンサルティングをお申し込みください。
参考文献:
[1] El Haddad, J., Bousquet, B., Canioni, L. and Mounaix, P., 2013. Review in terahertz spectral analysis. TrAC Trends in Analytical Chemistry, 44, pp.98-105.
[2] Dexheimer, S.L. ed., 2017. Terahertz spectroscopy: principles and applications. CRC press.
[3] Heyler, R.A., Carriere, J.T. and Havermeyer, F., 2013, May. THz-Raman: accessing molecular structure with Raman spectroscopy for enhanced chemical identification, analysis, and monitoring. In Next-Generation Spectroscopic Technologies VI (Vol. 8726, p. 87260J). International Society for Optics and Photonics.
[4] Gato, K., Fujii, M.Y., Hisada, H., Carriere, J., Koide, T. and Fukami, T., 2020. Molecular state evaluation of active pharmaceutical ingredients in adhesive patches for transdermal drug delivery. Journal of Drug Delivery Science and Technology, p.101800.
[5] Koide, T., Fukami, T., Hisada, H., Inoue, M., Carriere, J., Heyler, R., Katori, N., Okuda, H. and Goda, Y., 2016. Identification of pseudopolymorphism of magnesium stearate by using low-frequency Raman spectroscopy. Organic Process Research & Development, 20(11), pp.1906-1910.
[6] Tanabe, Y., Maeno, Y., Ohashi, K., Hisada, H., Roy, A., Carriere, J., Heyler, R. and Fukami, T., 2019. Screening a trace amount of pharmaceutical cocrystals by using an enhanced nano-spot method. European Journal of Pharmaceutics and Biopharmaceutics, 136, pp.131-137.
[7] Larkin, P.J., Wasylyk, J. and Raglione, M., 2015. Application of low-and mid-frequency Raman spectroscopy to characterize the amorphous-crystalline transformation of indomethacin. Applied Spectroscopy, 69(11), pp.1217-1228.
[8] Larkin, P.J., Dabros, M., Sarsfield, B., Chan, E., Carriere, J.T. and Smith, B.C., 2014. Polymorph characterization of active pharmaceutical ingredients (APIs) using low-frequency Raman spectroscopy. Applied Spectroscopy, 68(7), pp.758-776.
[9] Walker, G., Römann, P., Poller, B., Löbmann, K., Grohganz, H., Rooney, J.S., Huff, G.S., Smith, G.P., Rades, T., Gordon, K.C. and Strachan, C.J., 2017. Probing pharmaceutical mixtures during milling: The potency of low-frequency Raman spectroscopy in identifying disorder. Molecular Pharmaceutics, 14(12), pp.4675-4684.
[10] Marlina, D., Hoshina, H., Ozaki, Y. and Sato, H., 2019. Crystallization and crystalline dynamics of poly (3-hydroxybutyrate)/poly (4-vinylphenol) polymer blends studied by low-frequency vibrational spectroscopy. Polymer, 181, p.121790.
[11] Mork, A.J., Lee, E.M., Dahod, N.S., Willard, A.P. and Tisdale, W.A., 2016. Modulation of low-frequency acoustic vibrations in semiconductor nanocrystals through choice of surface ligand. The journal of physical chemistry letters, 7(20), pp.4213-4216.
[12] Sosorev, A.Y., Maslennikov, D.R., Kharlanov, O.G., Chernyshov, I.Y., Bruevich, V.V. and Paraschuk, D.Y., 2019. Impact of Low‐Frequency Vibrations on Charge Transport in High‐Mobility Organic Semiconductors. physica status solidi (RRL)–Rapid Research Letters, 13(3), p.1800485.
[13] Tharith, S., Hai, N.T.M., Lee, Y., Lim, S.Y., Van Quang, N., Kwanpyo, K., Sunglae, C. and Hyeonsik, C., 2020. Optical phonons of SnSe (1− x) S x layered semiconductor alloys. Scientific Reports (Nature Publisher Group), 10(1).
[14] Marble, K.S., Noojin, G.D., Coker, Z.N., Lalonde, J.W., Denton, M.L., Echchgadda, I., Yakovlev, V.V. and Cantu, J., 2019, March. Implementing low-frequency Raman spectroscopy to study biological molecules (Conference Presentation). In Optical Interactions with Tissue and Cells XXX (Vol. 10876, p. 108760H). International Society for Optics and Photonics.
[15] Steudel, R. and Eckert, B., 2003. Solid sulfur allotropes. In Elemental sulfur and sulfur-rich compounds I (pp. 1-80). Springer, Berlin, Heidelberg.
[16] Eckert, B. and Steudel, R., 2003. Molecular spectra of sulfur molecules and solid sulfur allotropes. In Elemental Sulfur und Sulfur-Rich Compounds II (pp. 31-98). Springer, Berlin, Heidelberg.
[17] Raw, A.S., Furness, M.S., Gill, D.S., Adams, R.C., Holcombe Jr, F.O. and Lawrence, X.Y., 2004. Regulatory considerations of pharmaceutical solid polymorphism in Abbreviated New Drug Applications (ANDAs). Advanced drug delivery reviews, 56(3), pp.397-414.
[18] Bras, L.P. and LOUREIRO, R., 2013. Polymorphic conversion monitoring using real-time Raman spectroscopy. Chimica Oggi-Chemistry Today, 31, p.5.
[19] Mazivila, S.J., Nogueira, H.I., Páscoa, R.N., Ribeiro, D.S., Santos, J.L., Leitão, J.M. and da Silva, J.C.E., 2020. Portable and benchtop Raman spectrometers coupled to cluster analysis to identify quinine sulfate polymorphs in solid dosage forms and antimalarial drug quantification in solution by AuNPs-SERS with MCR-ALS. Analytical Methods, 12(18), pp.2407-2421.
[20] Otaki, T., Tanabe, Y., Kojima, T., Miura, M., Ikeda, Y., Koide, T. and Fukami, T., 2018. In situ monitoring of cocrystals in formulation development using low-frequency Raman spectroscopy. International journal of pharmaceutics, 542(1-2), pp.56-65.
[21] Inoue, M., Hisada, H., Koide, T., Carriere, J., Heyler, R. and Fukami, T., 2017. In situ monitoring of crystalline transformation of carbamazepine using probe-type low-frequency Raman spectroscopy. Organic Process Research & Development, 21(2), pp.262-265.
[22] Nomura, K., Titapiwatanakun, V., Hisada, H., Koide, T. and Fukami, T., 2020. In situ monitoring of the crystalline state of active pharmaceutical ingredients during high-shear wet granulation using a low-frequency Raman probe. European Journal of Pharmaceutics and Biopharmaceutics, 147, pp.1-9.
[23] Walker, G., Römann, P., Poller, B., Löbmann, K., Grohganz, H., Rooney, J.S., Huff, G.S., Smith, G.P., Rades, T., Gordon, K.C. and Strachan, C.J., 2017. Probing pharmaceutical mixtures during milling: The potency of low-frequency Raman spectroscopy in identifying disorder. Molecular Pharmaceutics, 14(12), pp.4675-4684.
[24] Choi, H.H., Yi, H.T., Tsurumi, J., Kim, J.J., Briseno, A.L., Watanabe, S., Takeya, J., Cho, K. and Podzorov, V., 2020. A Large Anisotropic Enhancement of the Charge Carrier Mobility of Flexible Organic Transistors with Strain: A Hall Effect and Raman Study. Advanced Science, 7(1), p.1901824.
[25] Samuel, A.Z. and Hamaguchi, H.O., 2018. A General Approach for Estimating Lamella‐Thickness Distribution in Polymers with Low‐Frequency Raman Spectroscopy: Application to Lamella Formation in Crystallizing Polyethylene. Chemistry–A European Journal, 24(37), pp.9333-9339.
[26] Damle, V.H., Rajeswaran, B. and Tischler, Y.R., 2020. Low-Frequency Raman Spectroscopy as a Diagnostic Tool for COVID-19 and other Coronaviruses. Royal Society Open Science (In Review).