記事
イッテルビウムファイバーレーザが
最先端の神経科学を実現する
新機能と使いやすさを向上させたウルトラファースト光源
概要
マウスを用いた神経科学研究は、マルチフォトン顕微鏡の主要な応用分野です。 この記事では、いくつかの興味深い研究分野を検証することにより、この分野を概観します。 大脳皮質ニューロンネットワークが脳組織の表面下でどのように機能しているかを理解するための研究の一環として、赤色偏光機能プローブが開発されました。これらは、より深く浸透する長い(つまり、1ミクロンを超える)レーザ波長と組み合わせて利用されます。 最近、大規模な光遺伝学的光活性化や超深部イメージの3光子励起への関心が高まっていますが、いずれもフォトンを大量に必要とします。 チタン サファイアレーザではこれらのニーズに応えるのが簡単ではないため、レーザメーカーはイッテルビウムを添加したファイバーレーザエンジンに着目しました。このエンジンには、特に出力スケーリングと繰り返し精度が高いという利点があります。
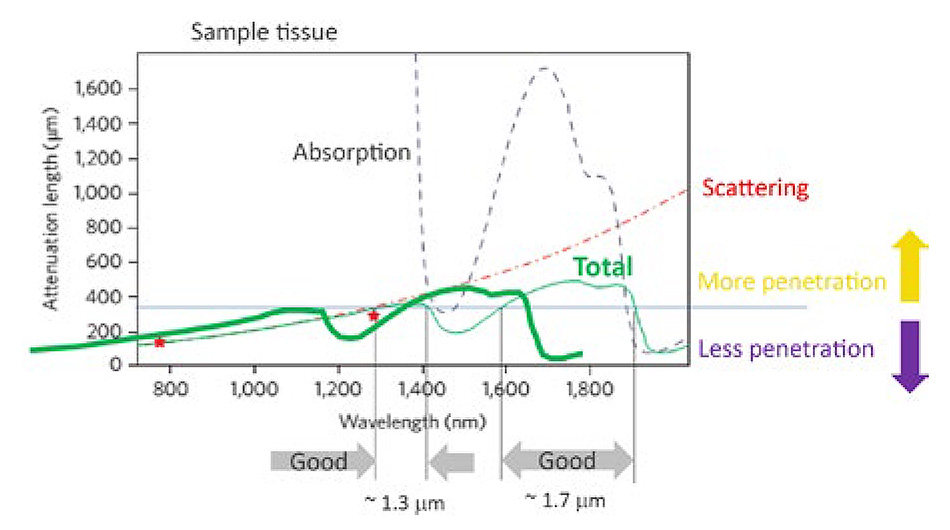
図1 : 生体の脳組織におけるウルトラファーストレーザの浸透深度は、散乱と吸収の組み合わせによって制限されます。 1300 nmと1700 nmを中心とした2つの最適な透過ウィンドウが存在します。 コーネル大学のクリス・シュウ教授との私信に基づいています。
イッテリビウムファイバーレーザ
イッテルビウムファイバーレーザは、1040 nm付近の固定波長出力で、光パラメトリックデバイスを使用して近赤外域全体をチューニングすることができます。 2光子イメージングで一般的に用いられる80 MHzの繰り返し周波数では、光パラメトリックオシレータ(OPO)がレーザヘッドに使用され、幅広い波長可変(660 nm~1320 nm)を実現しています。 これにより、短波長および赤方偏移した蛍光プローブとタンパク質の両方の効率的な2光子励起が可能になります。 このタイプのワンボックスソースの重要な別の利点は、ユーザーが2つの異なる出力波長にアクセスできることです。 1040 nmの固定Yb出力と、光遺伝学や他のタイプの「2波長」実験用の調整可能なOPO出力があります。 出力は各チャンネルとも通常1~3 Wです。
チタンサファイアとは異なり、イッテルビウムファイバーは出力の拡張が容易で、非常に柔軟な繰り返し周波数(最大10数MHz)の増幅器を作ることができ、より大きなニューロン集団の刺激に適しています。 3光子イメージングのような高出力と波長可変を必要とする応用は、光パラメトリック増幅器(OPA)を追加することで対応できます。 最近の進歩の中では、神経科学コミュニティの変化するニーズとレーザ技術との融合が際立っています。いくつかの概要を以下に示します。
イッテルビウムの利点
チタンサファイアとは異なり、イッテルビウムファイバーは出力の拡張が容易で、非常に柔軟な繰り返し周波数(最大10数MHz)の増幅器を作ることができ、より大きなニューロン集団の刺激に適しています。
深部3光子イメージング
神経科学における包括的なテーマの1つは、海馬に至るまでのマウス大脳皮質の全深度(1 mm超)をイメージングすることです。 レーザの透過と蛍光シグナルの取得が最大になる赤外線の「ウィンドウ」は、 1.3 µmと1.7 µmの2か所にあります(図 1参照)。 幸い、1.3 µmのウィンドウは緑色蛍光タンパク質に基づく3光子励起プローブに、1.7 µmのウィンドウはTdtomatoのような赤色蛍光タンパク質に基づくプローブに理想的です。 さらに、これらの波長は薄い骨にも適度に浸透するので、場合によってはガラス製の頭蓋のウィンドウが不要になります。
これらの波長での3光子イメージングは、調整可能な光パラメトリック増幅器をポンピングするイッテルビウムファイバー増幅器によって可能になりました。 従来のOPAでは、内部アーキテクチャが短パルスまたは広帯域の波長調整のいずれかに最適化されています。 しかし、3光子イメージングにおける理想としては、その両方が必要です。 そこでこの応用のために設計された最新のOPAでは、短パルス(50~70 fsに圧縮可能)を発生させるノンコリニア段と、その後に広帯域の波長調整を行うコリニア段が続くハイブリッド設計を採用しました。
Allen研究所(ワシントン州シアトル)のジャック・ウォーターズ博士率いるチームは、このような増幅器+OPAのタイプを使用して3光子イメージングを実行し、視覚刺激によってトリガーされる神経調節信号がマウスの大脳皮質でどのように処理されるかを観察しています。 ウォーターズ博士の目的は、できるだけ多くの大脳皮質を調査することでした。 1300 nmのレーザ光は、マウスの頭蓋骨に適度に透過するため、ガラス製のウィンドウや大脳皮質の広い領域にわたる冷却画像は必要ありません。 彼らの研究から得られたデータを図2に示します。
大規模ニューロン集団におけるCa2+活性のモニタリング
このタイプのOPAのパルス繰り返し周波数は、現在最大で2 MHzです。 しかし、対象となる脳容積内のすべてのニューロン、または少なくともいくつかの視野面内のすべてのニューロンのシグナル伝達を(Ca2+活性の測定を通じて)監視するなどの一部の応用では、より高い繰り返し周波数がすでに必要とされています。 大規模なニューロン集団をリアルタイムでイメージングするには、滞留時間の短縮を補うためのより高速なスキャニングとより高い出力が必然的に求められます。
アリパシャ・バジリ教授と、米国やヨーロッパのいくつかの研究所の共同研究者による最近の論文では、単一ニューロンの解像度を維持しながらこのタイプの大規模な監視を実現する新しい方法が成功のうちに実証されています[1]。 研究者たちは、920 nmのパルスを使用して、いくつかの際立った技術革新によって、一般的なカルシウム標識であるGCAMP6mの2光子励起を行いました。 時間集光(TeFo)と従来の集光を組み合わせ、集光されたビームウエストを1つのニューロンの典型的な寸法に合わせたのです。 大量のニューロンを監視するために、ボクセルごとに1つのレーザパルス(つまり、ニューロンごとに1つのパルス)をターゲットとしたスマートスキャンの使用を選択しました。 そのためには高パルスエネルギーが必要でした。 また、これらの研究者たちは、マルチヘルツ(3〜160 Hz)の表示速度を実現するために、4 MHzを超えるパルス繰り返し周波数を得たいと思っていました。 OPAはまだこの周波数に達していないため、研究者たちはイッテルビウムファイバー増幅器を使用して、光パラメトリックチャープパルス増幅器(OPCPA)と呼ばれる次世代の調整可能な超高速デバイスをポンピングすることにしました。 これにより、出力速度は数MHzまで上がり、優れたチャープオフセットによって調整できるようになりました。 このタイプのOPCPAは、コンパクトなヘッドと完全に統合されたイッテルビウムファイバー増幅器を備えたワンボックス製品としても利用できるようになりました。
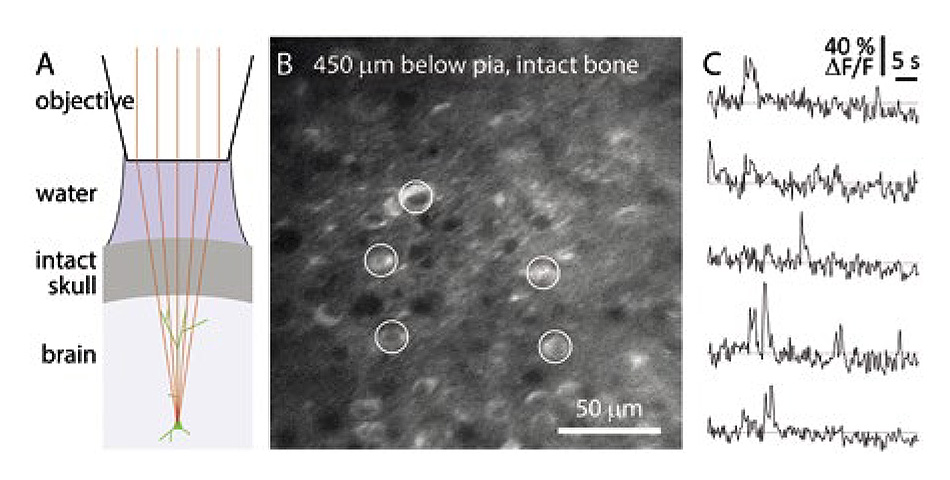
図2 : 損傷していないマウスの頭蓋骨を透過するカルシウムイメージング(Allen研究所の画像)。 (A)アクリルまたはカバースリップがない試料の概略図。 (B)Emx1-IRES-Cre;- CaMk2a-tTA;Ai94マウスの時間平均投影。 10 Hzフレームレート。 損傷していない頭蓋骨を透過する1300 nmの3P励起、厚さ300 µm未満。 顕微鏡の焦点は軟膜下450 µmに合わせてある。 (C)GCaMPを発現する体細胞からの自然カルシウム移行(パネルBの円)。 励起ソース : Coherent(Opera)OPAを備えたCoherent(Monaco)増幅器。
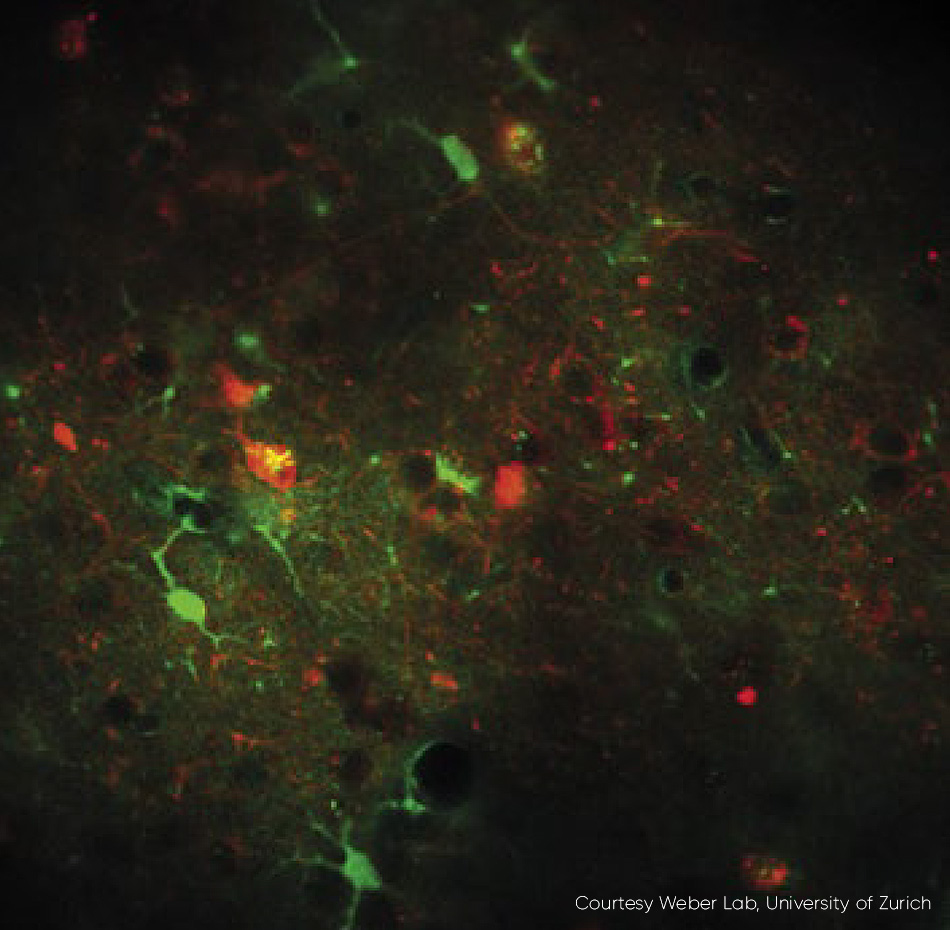
図3 : 高速フレームレートのカルシウムイメージングの例。 1040 nmで励起されたRCaMP1.07を発現するニューロン(マウスの生体内)。 励起ソース : Chameleon Discovery TPC。 チューリッヒ大学のWeber研究室のご厚意による掲載。
大規模ニューロン集団の光活性化
ニューロンで発現されるオプシンタンパク質の2光子吸収(つまり、多光子オプトジェネティクス)は、単一ニューロンの解像度でのニューロンの活性化またはサイレンシング、あるいはその両方のために、ますます活用されるようになっています。 これを多光子カルシウムイメージングと組み合わせると、ニューロンのネットワークをすべて単一のニューロン解像度で励起して監視することができます。これは「全光学生理学」と呼ばれることもあります。オプトジェネティクスの最初のパイオニアであるカール・ダイセロス教授は、2光子オプトジェネティクス刺激とサイレンシングの開発においても最前線の研究者です。 スタンフォード大学の同教授のグループは、この目的で2光子励起を使用する点で先導的な役目を果たしています。
ここでも、課題は出力と速度です。 ただし、イッテルビウム増幅器の1035 nm出力は、短波長オプシンの2光子励起に完全にマッチするため、調整可能な光パラメトリックデバイスは必要ありません。 また、高速(0.4〜50 MHz)であるため、最速の実験であってもサポートできます。 Deisseroth研究室のジム・マーシャル博士は次のように述べています。「10 MHzは、長年にわたる長期的研究で数十、あるいは数百のニューロンの効率的な光活性化を可能にする最適なパルスレートと思われます。 最新のイッテルビウムファイバー増幅器の高出力と高速パルスは、この用途に最適です」。
ダイレクトレーザ出力変調
神経科学の進歩は、最先端の研究のための新しい増幅器の材料と新しいパラメトリックデバイスアーキテクチャによって支えられています。それにとどまらず、主流である既存の2光子イメージング分野も、実用的な実装への新しいアプローチの恩恵を受けています。 その一例がレーザオシレータです。完全なマルチフォトン顕微鏡では、顕微鏡スキャンヘッドの上流でレーザ出力を制御する技術が要になります。 この技術は、単純なラスタースキャン実験の場合でも最適なパフォーマンスを実現するために欠かせません。顕微鏡のスキャンヘッドが次のyスキャンのためにビームスポット(フライバック)を返すため、レーザ出力を完全にブロックする必要があります。 これは、大規模なzスタックをスキャンする用途でも重要な機能です。システムが組織の奥に焦点を合わせるときに自然減衰が生じるため、高レーザ出力を使用して一定の画像強度を維持する必要があります。 また、高度化が進んでいる高速スキャンプロトコルでは、ボクセル滞留時間に対する最適な出力レベルを維持するために出力制御が使用される場合があります。
高速出力制御は、OEM顕微鏡メーカーや独自のマルチフォトン顕微鏡を構築するユーザーの大多数にとって、課題であることが分かっています。 具体的には、パルス幅を極度に延伸する(チャーピングする)ことなく、または高解像度画像に必要な円形のガウスビームの品質を損なうことなく、ビーム出力をリアルタイムで調整する方法が課題です。
最新のイッテルビウムベースのレーザでは、調整可能なビームと固定波長ビームがレーザヘッドから放射される前に、その両方を完全独立制御できるようになりました。つまり、パルス幅とTEM00ビームの品質が保証されます(M2 < 1.1)。 音響光学モジュレーター(AOM)は内製の顕微鏡に最適な0~10 Vのアナログ入力によって利用、外部制御できます。あるいは、AOMへの直接RF入力を介して、OEM顕微鏡メーカーのコストと複雑さを最小限に抑えることもできます。 高速出力変調のメリットを受ける用途としては、高速フレームレートのカルシウムイメージングがあります(図 3).
概要
分子プローブやイメージング方式の急速な発展と、レーザ技術の補完的な進歩との相乗効果により、マルチフォトン顕微鏡の性能は新たな高みに達しています。 神経科学者は、これらの進歩を活用して最先端の画像の解像度、深さ、機能をさらに向上させ、脳の謎の解明を続けています。
「10 MHzは、長年にわたる長期的研究で数十、あるいは数百のニューロンの効率的な光活性化を可能にする最適なパルスレートと思われます。 最新のイッテルビウムファイバー増幅器の高出力と高速パルスは、この用途に最適です」
-Jim Marshel - 神経科学者、スタンフォード大学医学部 - Deisseroth研究室
所属
1. Darryl McCoy、Coherent UK Ltd.、英国グラスゴー
2. Marco Arrigoni、Coherent, Inc.、米国カリフォルニア州、サンタクララ