がん細胞分析 — 新しいベクトル
レーザの技術革新と機器の技術革新の組み合わせにより、乳がん細胞に関する潜在的に重要な診断データへの新しいハイスループットルートが提供されています。
2023年7月31日 Coherent

フローサイトメトリーとは?
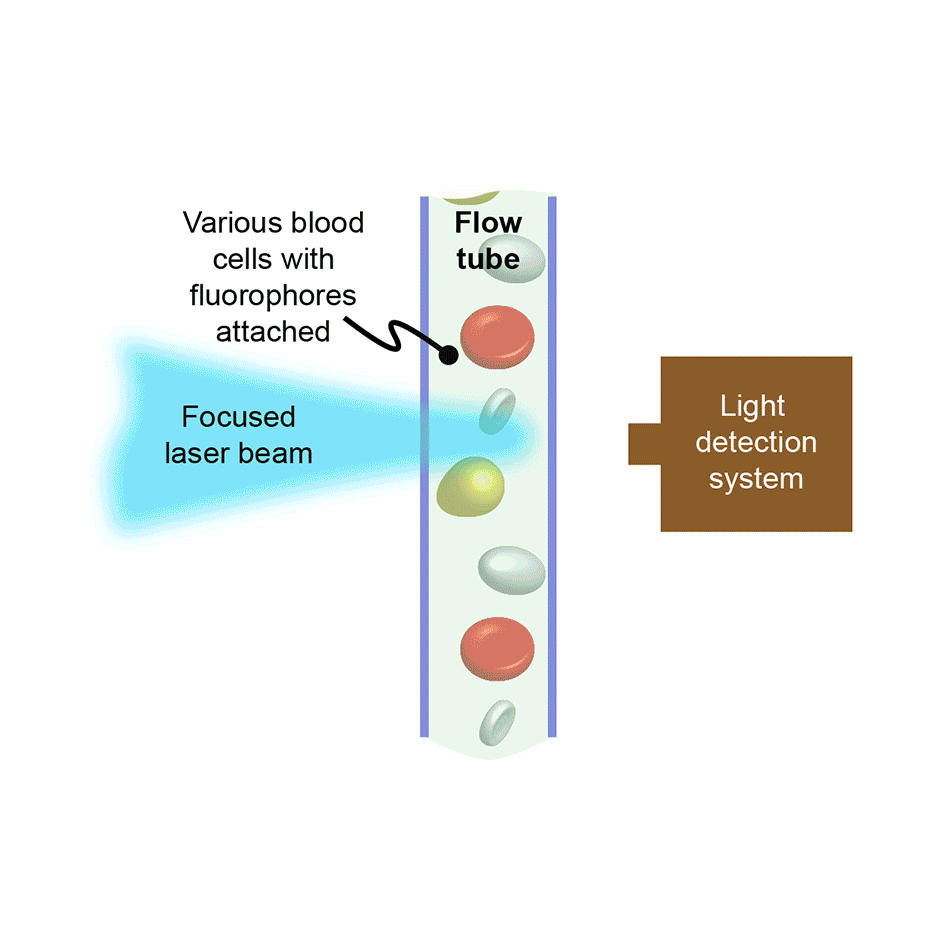
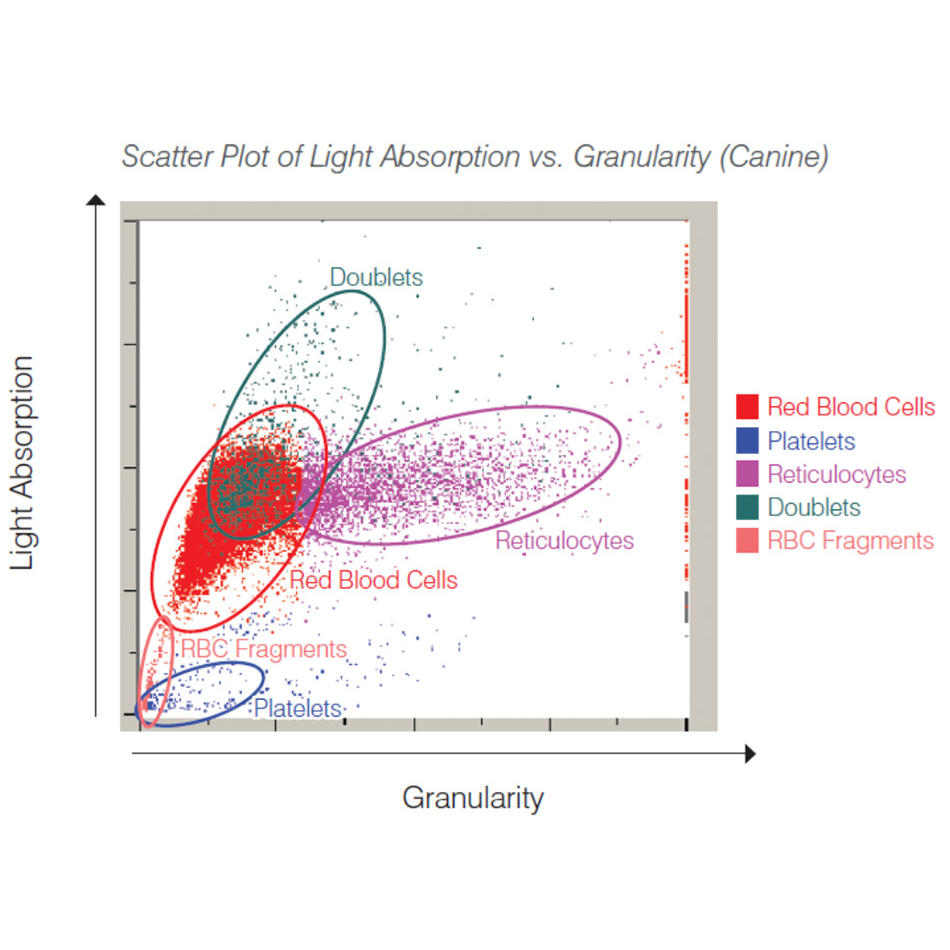
フローサイトメトリーでは、細胞やその他の生体粒子は、1つまたは複数の集光レーザビームと交差する相互作用ゾーンを高速で一列に流れるように強制されます。その結果、すべての細胞についてレーザ励起蛍光強度と、多くの場合散乱レーザ光強度が記録されます。計数機器では、これにより、細胞の大きな集団を迅速に分析できるため、たとえば、特定の種類の細胞は何パーセントであるかを確認することができます。ソーティングにも対応するよう構成された機器では、各細胞の蛍光/散乱シグネチャーに基づき、電場を用いて標的タイプの細胞をレセプタクルに偏向させ、個別に収集します。
フローサイトメトリーは高速であるため、多くの異なる用途に適しています。医学の分野では、たとえば全血球計算(CBC)のような血球分析に広く使用されています。また、研究室や治療薬開発において、血液細胞以外の哺乳類細胞の分析にもしばしば使用されています。これは、海水中の小さな生物の研究や、乳牛の雌の子孫の生産に有利に機能させるためなど、畜産用の精子の性選別に使われることもあります。
より多くの波長と紫外線波長を使用する
フローサイトメトリーは数十年の歴史があるとはいえ、非常にダイナミックな分野です。大きなトレンドは「マルチパラメータフローサイトメトリー」と呼ばれるもので、12種類もの異なるレーザ波長を用いて、多数の異なるパラメータについて細胞を分析します。レーザメーカーは、新しい波長のレーザを共通の形式で提供したり、複数のレーザをターンキーのライトエンジンにパッケージングしたりすることで、このトレンドに対応しています。(CoherentのOBIS製品ラインは、これらの両方の開発を具現化しています)。
もう1つのトレンドは、紫外線(UV)レーザ波長の使用の増加です。これにより、マルチパラメータ概念の拡張が可能になり、自家蛍光を使用することもできます。これは、蛍光染料やその他の添加物を使用することなく、自然に蛍光を発する細胞内の物質を指します。これらの物質には、いくつかの重要な代謝産物、NAD(P)H、およびFADが含まれます。
時間をかけて物事を解明する研究者たち
前回のCoherentの成功事例では、ジェシカ・ヒューストン教授(ニューメキシコ州立大学) の研究グループが時間分解フローサイトメトリーの開発と使用の先駆者であることについて説明しました。そこでは、NAD(P)HとFADをターゲットにしている理由について説明しました。これにより、細胞を数えることができるだけでなく、その代謝状態を判断することもできます。ヒューストン博士は次のように説明しています。「ほとんどのフローサイトメトリー測定は蛍光シグナルの強度に基づいています。しかし、蛍光色素が細胞の表面や内部にどれだけ結合しているかなど、この測定に光ノイズや誤差をもたらす要因はたくさんあります。また、私たちは各細胞からの蛍光シグナルの減衰時間も調べることにしました。寿命は濃度には依存せず、自家蛍光の原因となる蛍光色素または天然(内因性)物質の化学状態に依存します。内因性蛍光は、細胞の代謝状態に関する独特な情報を提供することができます。たとえば、この情報を使用して、細胞が正常に機能しているか、それとも形質転換した(がん化した)細胞であるかを評価できます。
彼らは、特にNAD(P)HとFADに興味を持っています。なぜなら、これらの補酵素の蛍光寿命は、それらがタンパク質に結合しているかどうかを示すからです。一方、これは主に酸化的リン酸化と、解糖と呼ばれるプロセスによって、細胞がエネルギーを得るためにどのように糖を酸化しているかを示しています。がん細胞の多くや「欠陥のある」細胞、または損傷を受けた細胞では、高レベルの「遊離」、つまり結合していないNAD(P)Hが測定されていることが報告されており、これは細胞が解糖と呼ばれる効率の悪いプロセスでエネルギーを生成していることを示しています。光学的に測定されたNAD(P)Hに対するFADの量の比は、細胞内の代謝活性を示し、酸化還元比と呼ばれます。
CWレーザを使った巧妙な技法
最初、ヒューストン博士のグループはレーザビームのパルスを使用して時間依存のデータを得ました。その後、機器が2つの方法のいずれかで蛍光パルスの減衰を記録します。その方法は、レーザの励起がオフになったときのリアルタイムの減衰曲線、またはレーザが非常に高速で繰り返し変調されたときの周波数領域での減衰曲線のいずれかです。後者の方法は、同研究グループが波長375 nmのOBISレーザを使ってFADをモニターしたやり方です。しかし、酸化還元比を正確に測定するには、理想的にはFADとNAD(P)Hの両方を測定する必要があります。また、NAD(P)Hの蛍光減衰時間を独自に測定するには、UV域(約349 nm)でさらに励起する必要があります。
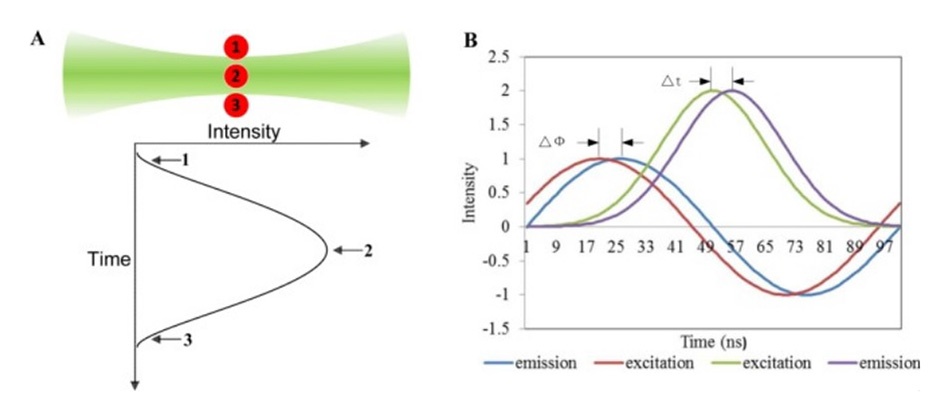
nFLIC法の主要概念。蛍光は、細胞が不均一なビームプロファイルを通過する際に増減します。励起プロファイルと比較した位相遅延は、蛍光寿命の直接的な指標となります。画像提供:ヒューストン研究室。
最近、Coherentはヒューストン博士のグループに、349 nmを出力するように開発された新型OBISモデルを供給しました。しかし、この機器は375 nmのレーザとは異なる内部技術を使用しており、直接変調するのはそれほど簡単ではありません。数年前、同グループは連続波(CW)レーザを使用して平均蛍光寿命を測定する非変調蛍光寿命サイトメトリー(nFLIC)と呼ばれる巧みな技術を開発したため、これは彼らにとって問題ではありませんでした。
図1は、その仕組みを示しています。完璧なTEM00出力ビームを備えたレーザを使用すると、細胞が焦点を通過するときに励起確率が、ガウスビームプロファイル全体で増減します。しかし、蛍光減衰時間がゼロでないため、蛍光パルス遅延(FPD)と呼ばれるものが発生します。細胞がビームを通過すると、蛍光強度が、ガウス励起プロファイルよりも徐々に下がります。そして、ヒューストン博士のチームは、FPDが細胞の平均蛍光寿命の有効な表現であることを厳密に証明しました。
新型OBIS 375は、その優れた出力ビーム品質により、ヒューストン研究室でのnFLIC研究に大いに役立っています。ヒューストン教授は次のように説明しています。「まず、必要な、クリーンなTEM00ビーム形状が得られました。また、非常に低光ノイズのレーザでもあります。そして同様に重要なことは、出力、ビーム形状、ビームポインティングが非常に安定していることです。特殊な蛍光ビーズを使用して蛍光パルス減衰と蛍光寿命の関係を確実にキャリブレーションできるため、これは重要です」
がん細胞の耐性
がん細胞は、他の強力な化学療法薬に対してしばしば耐性を獲得するため、手強い敵です。CYTO 2023カンファレンス(カナダ、モントリオール)で、ヒューストン研究室の大学院生であるサマンサ・ヴァレンティノは、タモキシフェンと呼ばれる化学療法薬に対する乳がんの耐性をモニターするための強力なツールとして、時間分解フローサイトメトリーを使ってFAD/NADH蛍光寿命と酸化還元比を測定することの価値を示す傑出したプレゼンテーションを行いました。
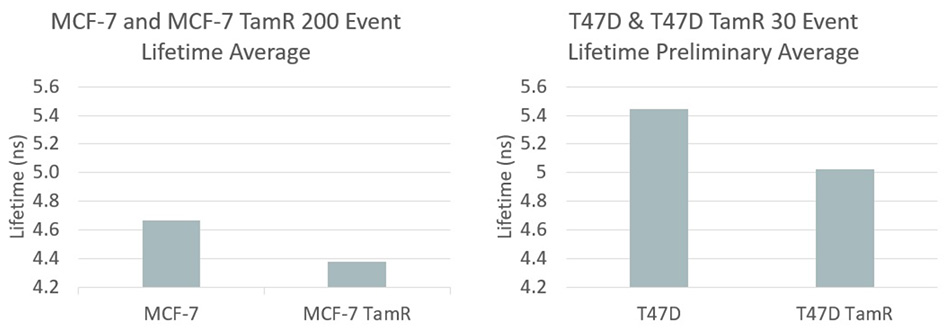
MCFおよびT47D乳がん細胞の蛍光寿命データ - 感受性細胞株と耐性細胞株の比較。画像提供:ヒューストン研究室。
具体的には、タモキシフェンは「エストロゲン受容体陽性」の乳がんに有効で、広く使用されている薬です。寛解を得るために使用されます。ただし、耐性は通常、治療開始から2~5年以内に生じます。ヴァレンティノはまず、薬剤耐性がんなど、より悪性度の高いがん細胞では酸化還元比がより偏っていることが多いと指摘しました。彼女は2種類の乳がん(MCF-7とT47D)を研究しました。どちらの場合も、タモキシフェンに感受性のあるがん細胞株と、タモキシフェンに耐性のある細胞株とを比較しました。図2は結果をまとめたもので、彼らのアプローチにより感受性細胞タイプと耐性細胞タイプにおいて統計的に有意な差があることが明らかになりました。がん細胞集団の薬剤耐性の特徴を迅速に分析する能力は、治療薬開発と研究の両方において、そして改善された患者固有の治療を提供するうえで、がんと闘うための重要な新しいツールになる可能性があることは言うまでもありません。
概要
フローサイトメトリー、DNAシークエンシング、組織生検など、レーザ励起蛍光に基づく分析技術は、個別化医療のトレンドを支えるますます重要なツールとなっており、最近のCovid-19のパンデミックによってさらに加速されました。Coherentは、スピードとデータ品質を向上させ、使用への障壁を下げ、機器全体のコストを削減するレーザツールで、これらの技術の進歩をサポートすることに熱心に取り組んでいます。