WHITEPAPER
Pharma-Anwendungen der quantitativen THz-Raman-Analyse
Überblick
Die THz-Raman™-Spektroskopie (auch Niederfrequenz-Raman genannt) basiert auf der Erkennung von Schwingungen im Bereich von 0–200 cm-1 zusätzlich zum chemischen Fingerabdruckbereich von 200–1800 cm-1, der mit herkömmlichem Raman erfasst wird. Sie hat sich in jüngster Zeit zu einer leistungsstarken quantitativen Analysemethode entwickelt, die in Echtzeit Informationen über Struktur und Phase der Probe liefert und alle Vorteile – einfache Anwendung, Fernerkundung und direkte Messung – bietet, die typischerweise mit optischen Spektroskopieverfahren wie NIR oder FTIR verbunden sind. Diese Struktur- und Phaseninformationen können für pharmazeutische Anwendungen besonders wichtig sein, erforderten aber bisher eine umständliche Probenvorbereitung und den Einsatz komplexerer Offline-Methoden wie die Pulver-Röntgenbeugung (PXRD). THz-Raman-Systeme können nun als eigenständige Instrumente eingesetzt oder in bestehende konventionelle Raman-Instrumente integriert werden, um deren Empfindlichkeit im Bereich niedriger Wellenzahlen zu erhöhen. Sie sind für den Einsatz mit Tauchsonden, als Benchtop-Instrumente für Probengefäße, als Mikroskopzubehör und integriert in Well-Plate-Reader für Screening-Anwendungen mit hohem Durchsatz erhältlich. Es gibt zahlreiche Anwendungen in der pharmazeutischen Industrie, und dieses Whitepaper untersucht einige repräsentative Anwendungen, die ausgewählt wurden, um die Breite des THz-Raman-Nutzens für die Pharmaindustrie zu verdeutlichen.

- Polymorphe Identifizierung
- Kokristallbildung
- Kristallinität vs. Amorphe Überwachung
- Mehrere Hydrate (Pseudo-Polymorphismus)
- Hochdurchsatz-Screening
Identifizierung von Polymorphen
Viele pharmazeutische Wirkstoffe (APIs) können in mehreren Formen oder Polymorphen kristallisiert werden. Dies ist besonders wichtig bei schwer löslichen Arzneimitteln, bei denen verschiedene Polymorphe ganz unterschiedliche Auflösungseigenschaften im Magen-Darm-Trakt haben können, was sich auf ihre Bioverfügbarkeit und damit auf ihre Wirksamkeit auswirkt. In der Vergangenheit wurde der Polymorphismus vieler Arzneimittel zufällig oder durch manuelle, zeitaufwändige Methoden festgestellt. Mit Hilfe der kombinatorischen Chemie und des Hochdurchsatz-Screenings ist es heute möglich, stabile polymorphe und/oder hydrat- bzw. wasserfreie Formen von Arzneimitteln einfach und umfassend zu identifizieren. Dies bedeutet, dass eine schnelle und zuverlässige Identifizierung von Polymorphen während des Entwicklungs-, Herstellungs- und Qualitätssicherungsprozesses in der pharmazeutischen Produktion entscheidend ist.
Polymorphe Stoffe haben die gleiche molekulare Zusammensetzung, unterscheiden sich aber nur in der Art und Weise, wie die Moleküle in einem Kristallgitter angeordnet sind. Mit den herkömmlichen optischen Analysemethoden ist es daher schwierig, verschiedene Polymorphe zu identifizieren. FTIR-, NIR- und herkömmliche Raman-Analysen beispielsweise beruhen alle auf der Messung von Spektralpeaks, die auf intramolekulare Schwingungen zurückzuführen sind und die molekulare Zusammensetzung anzeigen. Infolgedessen wurde bei der Analyse von Polymorphen häufig auf andere Methoden zurückgegriffen, wie z. B. Pulver-Röntgenbeugung (PXRD) oder Festkörper-NMR (ss-NMR), die eine Vorbereitung der erfassten Proben und eine komplexe Instrumentierung erfordern. THz-Raman hat sich als ideal für diese Anwendung erwiesen, da es niederenergetische Schwingungen in Proben misst und diese Schwingungsspektralspitzen hauptsächlich von intermolekularen Schwingungen wie Phononmoden und Gitterschwingungen herrühren. Das THz-Raman-Spektrum ist daher sehr empfindlich für selbst subtile Unterschiede in den Kristallformen. Da THz-Raman keine spezielle Probenvorbereitung erfordert, ist es auch mit Initiativen der Grünen Chemie zur Reduzierung des Lösungsmittelverbrauchs vereinbar.
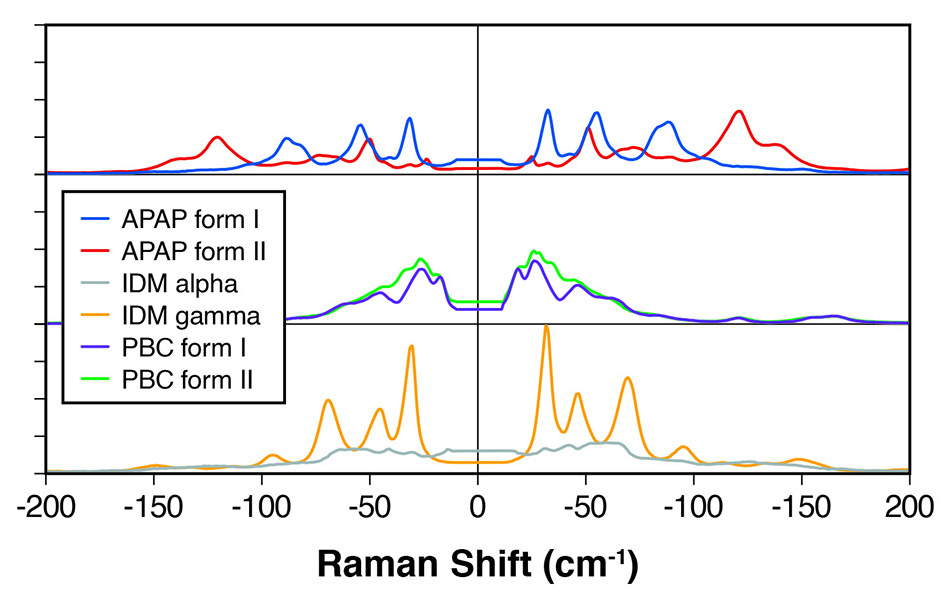
Abbildung 1: THz-Raman-Spektren für polymorphe Formen verschiedener Wirkstoffe mit deutlich differenzierten Peaks.
In einer Veröffentlichung in Applied Spectroscopy [1] haben Wissenschaftler von Coherent (ehemals Ondax) und Bristol-Myers Squibb beispielsweise den erfolgreichen Einsatz der THz-Raman-Analyse zur quantitativen Unterscheidung von polymorphen und amorphen Formen für viele gängige Wirkstoffe, darunter Carbamazepin (CBZ), Koffein, Theophyllin und Apixaban, nachgewiesen. Sie erklärten, dass THz-Raman so genannte optische Phononen nachweist, die für aromatische Molekülstrukturen einen erwarteten Frequenzbereich bis zu etwa 130 cm-1 (4 THz) haben. Sie zeigten, dass jedes Polymorph eine charakteristische THz-Raman-Signatur aufweist, die aus Gittermoden und einigen niederfrequenten (z. B. torsionalen) intramolekularen Schwingungen besteht.
In einer Studie zur Identifizierung von Polymorphen wiesen Wissenschaftler von Coherent [2] die klare spektrale Unterscheidung zwischen den Polymorphen verschiedener anderer Wirkstoffe nach, darunter Indomethacin, Probucol und Paracetamol – siehe Abbildung 1. Sie fassten zusammen, dass THz-Raman-Systeme eine schnelle, eindeutige Unterscheidung von Polymorphen ermöglichen und damit die für die chemische Identifizierung verwendete Raman-Region mit höherer Frequenz, den „chemischen Fingerabdruck“, perfekt ergänzen.
Kokristallbildung
Die Optimierung von Polymorphen allein reicht nicht immer aus, um die Formulierung eines Wirkstoffs mit der erforderlichen thermischen Stabilität, Auflösungsrate usw. zu ermöglichen. Daher hat die Pharmaindustrie eine Reihe anderer Ansätze entwickelt, um diese Eigenschaften zu verändern. Ein Beispiel ist die Verwendung von Kokristallen zur Regulierung der Löslichkeit, Stabilität und Bioverfügbarkeit des Wirkstoffs. Kokristalle sind molekulare Kristalle, die durch schwache intermolekulare Wechselwirkungen wie Wasserstoffbrückenbindungen zwischen zwei verschiedenen molekularen oder ionischen Verbindungen entstehen. Sie sind auch für Sprengstoffe, Agrochemikalien und Pigmente von Interesse. In der Pharmazie werden sie hauptsächlich für schwerlösliche Wirkstoffe verwendet.
Ein Kokristall besteht aus einem aktiven pharmazeutischen Wirkstoff (API) und einem so genannten Coformer. Bei der gleichen Wirkstoff/Coformer-Paarung sind aufgrund unterschiedlicher Stöchiometrien oft verschiedene Kokristalle möglich. Zum Beispiel kann das Carbamazepin:4-Aminobenzoesäure-Kokristallsystem in stöchiometrischen Kombinationen von 1:1, 2:1 und 4:1 vorliegen, die jeweils spezifische Auflösungsraten und andere wichtige physiochemische Eigenschaften aufweisen. Kokristalle können durch eine Vielzahl von Festkörper-, Aufschlämmungs- und Lösungsmethoden gebildet werden, und die Herstellung von Kokristallen bleibt ein aktives Forschungsgebiet.
Daher besteht in der Forschung, bei der Qualitätssicherung, beim Screening und bei der Prozessüberwachung ein allgemeiner Bedarf an einer zuverlässigen und schnellen Methode zur quantitativen Identifizierung spezifischer Kokristalle. Herkömmliche optische Methoden konzentrieren sich auf spektrale Peaks, die auf kovalenten Bindungen beruhen, und können bestenfalls subtile Datenunterschiede zwischen Kokristallen und Mischungen und dann auch zwischen verschiedenen Kokristallen zeigen. Die Pulverröntgendiffraktometrie (PXRD) und die Kernspinresonanzspektroskopie (NMR) können die Daten liefern, erfordern jedoch erfasste und vorbereitete Proben und kostspielige Geräte für Offline-Messungen. Da es sich bei THz-Raman jedoch um eine optische Methode handelt, die hauptsächlich intermolekulare Schwingungen und Gittermoden nachweist, eignet sie sich sehr gut für diese Analyse, wie das Beispiel in Abbildung 2 zeigt.
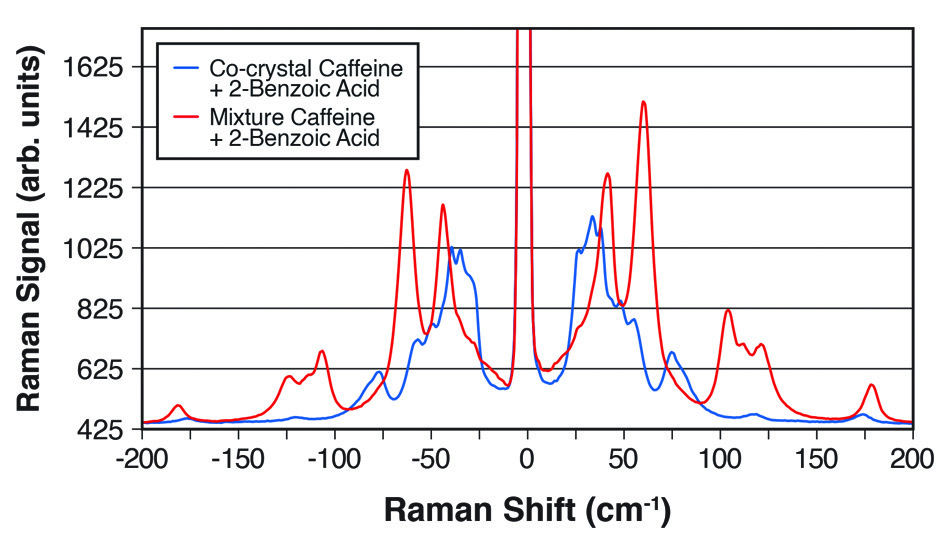
Abbildung 2: THz-Raman-Spektren, die die deutlichen Unterschiede zwischen einem 1:1-Kokristall aus Koffein und 2-Benzoesäure und einer einfachen Mischung der beiden Chemikalien zeigen.
In einem Beitrag in der Zeitschrift Industrial & Industrial Chemical Research [3] zeigten Wissenschaftler von Coherent (ehemals Ondax), der Meiji Pharmaceutical University (Kiyose, Tokio) und dem Japan National Institute of Health Sciences (Setagaya, Tokio), dass ein THz-Raman-Spektrometer die Bildung von Kokristallen quantitativ überwachen kann. Konkret untersuchten sie 1:1- und 2:1-Kokristalle von Carbamazepin und 4-Aminobenzoesäure, die durch die Reaktionskristallisationsmethode (RCM) mit Ethanol als Lösungsmittel gebildet wurden. THz-Raman-Daten wurden in Echtzeit mit einem fasergekoppelten Spektrometer und einer Tauchsonde gewonnen, wobei die Datenanpassung auf einer multivariaten Kurvenauflösung (MCR) basierte. Neben der quantitativen Probenanalyse zeigten sie auch, dass die Technik verwendet werden kann, um die Umwandlung zwischen Kokristallen mit unterschiedlichen Stöchiometrien zu verfolgen und die Reaktionsgeschwindigkeit und die Zeit bis zum Endpunkt zu bestimmen, was den Nutzen von THz-Raman als nützliches Echtzeit-Prozessanalysewerkzeug für Kokristallisationsprozesse bestätigt.
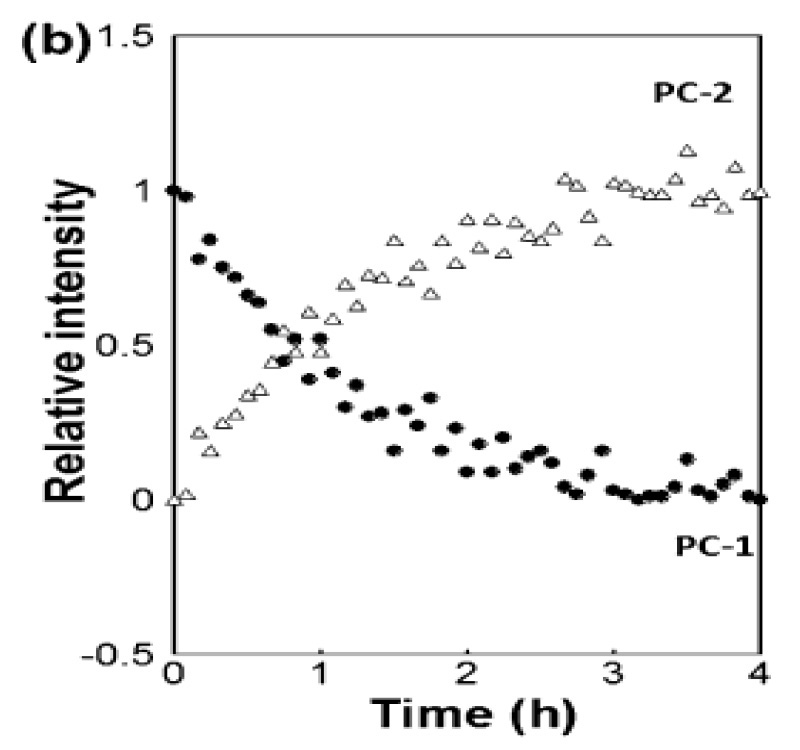
Abbildung 3: Echtzeitüberwachung der Umwandlung von 1:1-Kokristallen von Carbamazepin und 4-Aminobenzoesäure in 2:1-Kokristalle, basierend auf MCR-Anpassung der THz-Raman-Spektraldaten. Nachdruck aus [3] mit Genehmigung.
Kristallinität vs. Amorphe Überwachung
Das niederfrequente Raman-Spektrum wird von scharfen Peaks dominiert, die auf Kristallgittermoden und optische Phononen zurückzuführen sind. Das bedeutet, dass ein THz-Raman-Analysator die Konzentration eines bestimmten Kristalls in einem Phasengemisch messen kann, d. h. als „Kristallinitätsmonitor“ fungiert [4] Der Goldstandard bei der Kristallidentifizierung ist die Pulverröntgendiffraktometrie (PXRD), die Daten in Form eines Musters heller Flecken bei bestimmten Beugungswinkeln erzeugt, die auf den Gittereigenschaften des Materials basieren. Amorphe Materialien erzeugen jedoch aufgrund ihrer semi-zufälligen, ungeordneten Ausrichtung der Moleküle einen breiten Halo von gebeugter Röntgenstrahlung, der als Rauschuntergrenze wirkt und die Nachweisgrenze (LOD) festlegt. Dies bedeutet, dass es in der Regel nicht möglich ist, den Kristallinitätsgehalt mit PXRD zuverlässig zu messen, wenn dieser unter etwa 5 % liegt.
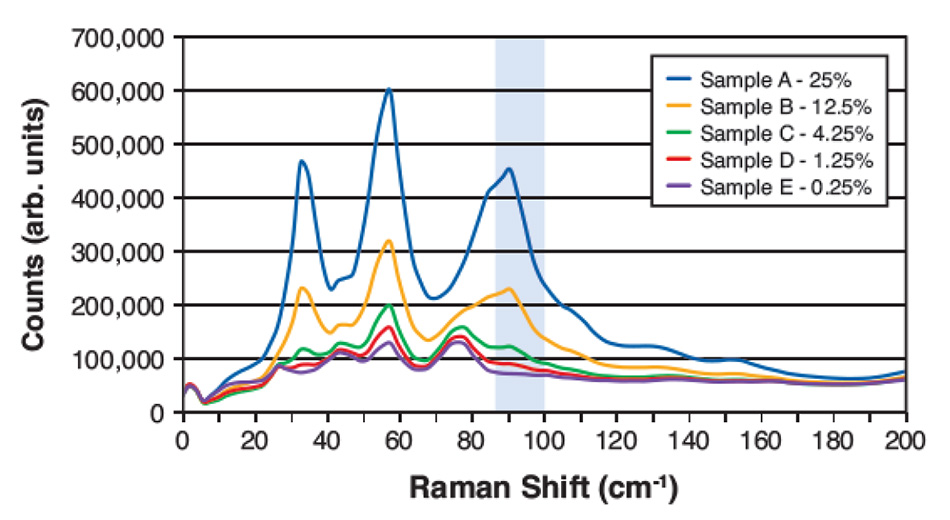
Abbildung 4: THz-Raman-Spektren für fünf verschiedene gewichtsmäßig gemessene Mischungen von Acetaminophen in Mannitol. Die hervorgehobene Region zeigt den Bereich mit starken Acetaminophen-Signalen und geringer Überlappung mit Mannitol, der zur Berechnung des Gehalts verwendet wurde.
Bei der THz-Raman-Spektroskopie sind jedoch einige der scharfen Peaks, die auf kristalline Komponenten zurückzuführen sind, selbst bei niedrigen Konzentrationen noch deutlich zu erkennen. Hier hängt der LOD von der Auswahl der Spektralkomponenten des Zielobjekts ab, wobei die Überlappung mit den Spektralmerkmalen des Hintergrundmaterials minimiert wird. Abbildung 4 zeigt THz-Raman-Spektren aus einer kürzlich durchgeführten Studie an verdünnten Gemischen von Acetaminophen in Mannitol. Der hervorgehobene Frequenzbereich wurde aufgrund der geringen Überlappung des Paracetamol-Signals mit Signalen von Mannitol für die Anpassung ausgewählt. Nach Berücksichtigung der Dichteunterschiede zwischen den Materialien und der Durchführung von Hintergrund- und Basislinienkorrekturen wurde eine vorhergesagte (gewichtsbezogene) Konzentration auf der Grundlage der Größe des über dieses Spektralfenster integrierten Restsignals berechnet.
Abbildung 5 zeigt eine Darstellung der berechneten gegenüber der tatsächlichen Konzentration unter Verwendung dieser einfachen Berechnung für fünf verschiedene Konzentrationen. Auf der Grundlage dieses Diagramms wurde die LOD auf ~1 % festgelegt, wobei die höheren Fehler bei niedrigen Konzentrationen auf örtlich begrenzte räumliche Variationen der Probenmischung und trotz einer gewissen Restüberlappung zwischen den Spektralsignaturen in der analysierten Region zurückzuführen sind. Dies liegt deutlich unter der typischen LOD für PXRD und ist vergleichbar mit Festkörper-NMR (ss-NMR). Verschiedene Materialkombinationen mit besserer Mischungsgleichmäßigkeit oder besserer Trennung zwischen den spektralen Peaks würden eine noch niedrigere LOD aufweisen.
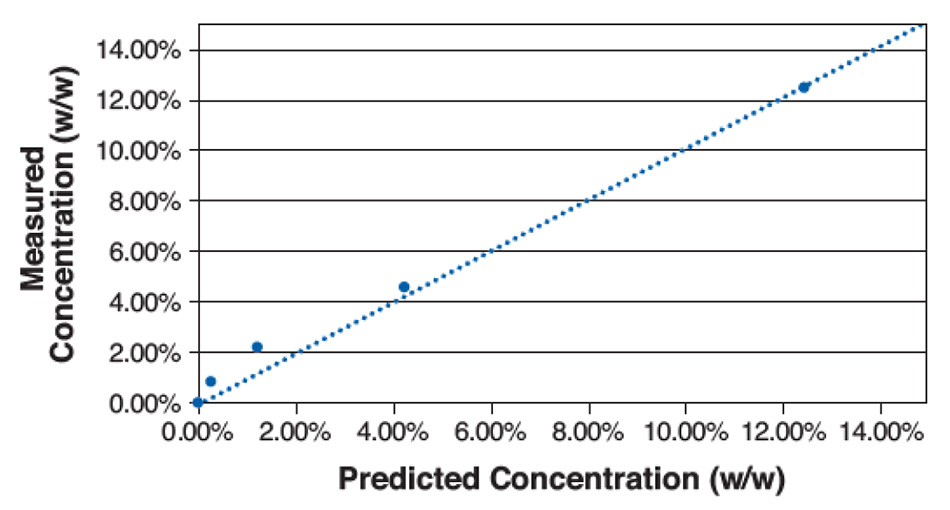
Abbildung 5: Darstellung der gemessenen Konzentration gegenüber der vorhergesagten Konzentration für verschiedene Gemische von Acetaminophen in Mannitol.
Daten anderer Systeme aus dem Anwendungslabor für THz-Raman-Spektroskopie von Coherent deuten darauf hin, dass in einigen Fällen der Prozessüberwachung sogar eine einfachere Analyse zur Quantifizierung des Kristallinitätsgrades ausreichen kann. Insbesondere sind die kristallinen Peaks im Vergleich zum breiten Boson-Merkmal eines amorphen Hintergrunds so scharf, dass es oft möglich ist, den Grad der Kristallinität einfach aus der Analyse der mittleren spektralen Ableitung (Steigung) im Niederfrequenzbereich zu bestimmen.
Die Möglichkeit, die Kristallinität sowohl im Labor als auch online in Echtzeit zu bestimmen, ist eindeutig ein Vorteil, der in vielen Bereichen der Pharma- und Chemieindustrie breite Anwendung findet.
Mehrere Hydrate (Pseudo-Polymorphismus)
Pseudo-Polymorphismus bezieht sich auf Kristallphasen ein und derselben Verbindung, die sich durch die Menge des in das Kristallgitter eingebauten Lösemittels unterscheiden. Bei wässrigen Gemischen sind dies zum Beispiel Hemi-, Mono-, Di- und Trihydratphasen sowie deren Mischungen. In einer weiteren veröffentlichten Studie [5] demonstrierten Wissenschaftler von Coherent (ehemals Ondax), der Meiji Pharmaceutical University (Kiyose, Tokio) und dem Japan National Institute of Health Sciences (Setagaya, Tokio) die Fähigkeit der THz-Raman-Spektroskopie, die Menge verschiedener Hydrate in festen Proben von Magnesiumstearat (Mg-St) zu bestimmen. Sie stellten fest, dass frühere Studien gezeigt hatten, dass die Schmierung, Verdichtung und Fließfähigkeit des Pulvers bei den Monohydrat- und Dihydratformen von Mg-St unterschiedlich waren. Sie stellten auch fest, dass die Identifizierung des Magnesiumsalzes, der relative Gehalt an Stearinsäure durch Gaschromatographie und der Wassergehalt zusammen nicht ausreichen, um den Pseudo-Polymorphismus von Mg-St eindeutig zu bestimmen. Diese Ungewissheit kann zunehmend problematisch werden, wenn global agierende Unternehmen ihre Rohstoffe von verschiedenen Standorten beziehen, die ein unterschiedliches Maß an guter Herstellungspraxis aufweisen.
In dieser Studie wurden 10 Mg-St-Proben von verschiedenen Lieferanten mittels PXRD sowie Thermogravimetrie und Differentialthermoanalyse (TGDTA) analysiert, so dass sie nach Hydratart(en) beschrieben werden konnten. Konventionelles Raman (chemischer Fingerabdruck) bei hohen Frequenzen zeigte nur sehr geringe Unterschiede zwischen den Hydraten. Wie aus Abbildung 6 hervorgeht, gab es jedoch bei der Messung der einzelnen Pseudopolymorphe von Mg-St im Niederfrequenzbereich Unterschiede bei den Peaks zwischen 30 und 60 cm-1 und zwischen 100 und 180 cm-1. Insbesondere war im Spektrum jedes Hydrats ein Peak im Bereich zwischen 100 und 180 cm-1 deutlich abgetrennt, was eine Unterscheidung zwischen dem Monohydrat und den anderen Hydraten auch dann ermöglichte, wenn das Mg-St eine Mischung von Pseudopolymorphen war.
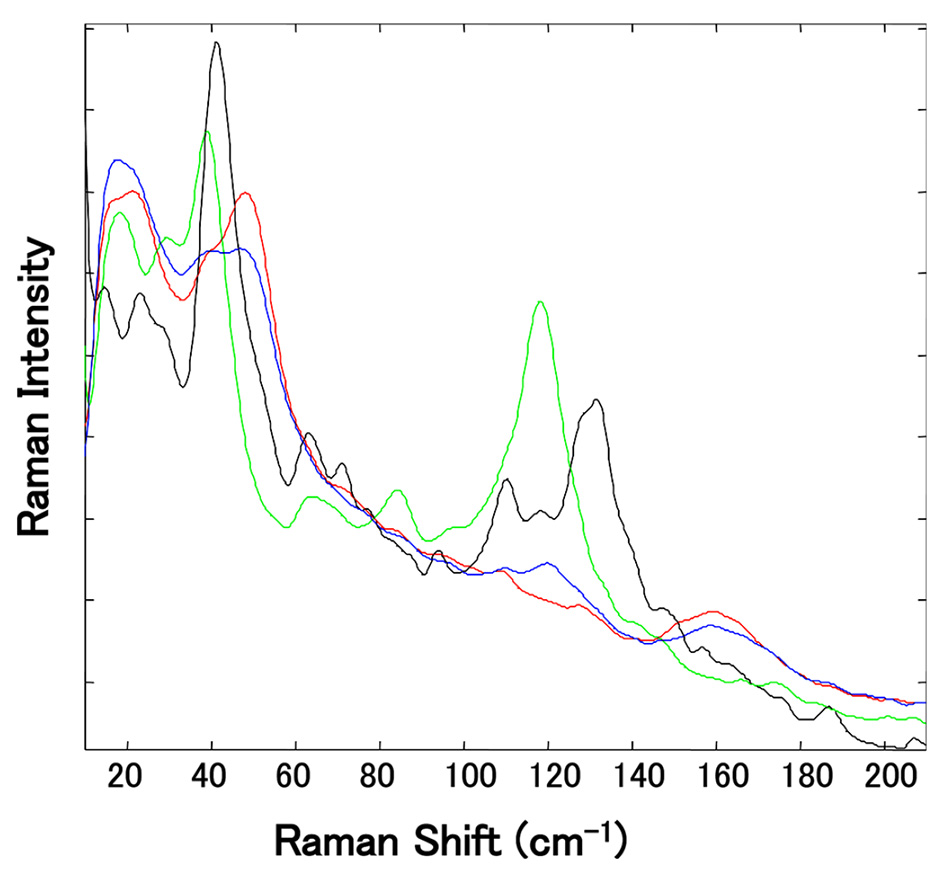
Abbildung 6: Vergrößerte Ansicht der normalisierten THz-Raman-Spektren mehrerer unabhängig voneinander hergestellter Mg-St-Proben. (Der grüne Peak bei 118 cm-1 ist auf das Vorhandensein von Trihydrat zurückzuführen, während der schwarze Peak bei 129 cm-1 mit dem Dihydrat assoziiert ist). Nachdruck aus [5] mit Genehmigung.
Hochdurchsatz-Screening
Die oben genannten Anwendungen verdeutlichen, dass die THz-Raman-Spektroskopie eine bequeme und einfachere Alternative zu PXRD und ss-NMR zur schnellen Bestimmung der durchschnittlichen Phase einer Probe darstellt. Keine dieser etwas schwerfälligen älteren Techniken kann eine räumliche Zuordnung vornehmen. Im Gegensatz dazu erlaubt die Möglichkeit, Raman- und THz-Raman-Messungen durch ein Objektiv durchzuführen, sowohl das Einstellen (Zoomen) als auch das Scannen des Probenahmebereichs, wodurch die Abbildung einer Probe unter einem Mikroskop sowohl hinsichtlich der Zusammensetzung als auch der Struktur/Phase ermöglicht wird. Diese Imaging-Fähigkeit ermöglicht auch das Mapping von Well-Platten und das Mapping innerhalb von Wells fürHochdurchsatz-Screening (HTS)-Anwendungen, und Coherent bietet ein vollautomatisches Well-Platten-Lesegerät – den TR-WPS – für die schlüsselfertige Analyse der meisten gängigen Well-Plattenformate von 6 bis 1536 Wells [6].
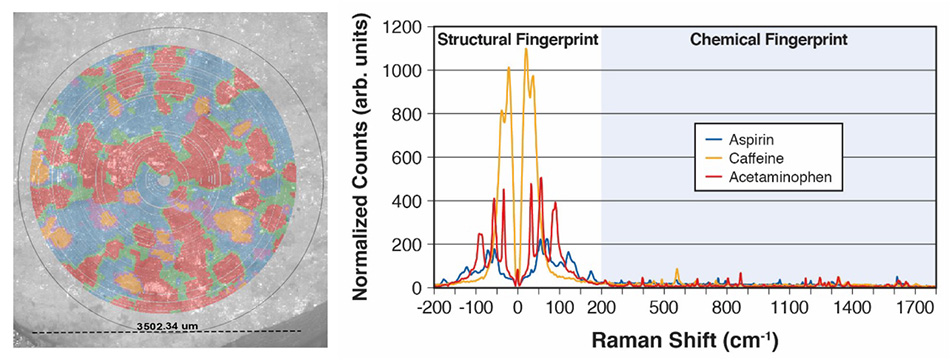
Abbildung 7: Eine Excedrin-Tabelle, die gleichzeitig für drei Wirkstoffe kartiert wurde, und die entsprechenden THz-Raman-Spektren, die zur Erstellung dieser Karte auf der Grundlage von Hauptkomponentenanalyse (PCA) und Clustering verwendet wurden.
Abbildung 7 zeigt Falschfarbendaten aus einer einfachen Demonstration des TR-WPS im Anwendungslabor von Coherent. Konkret wurde eine einzelne Excedrin®-Tablette in eine Vertiefung gelegt, und innerhalb von 9 Minuten wurden über einen Bereich der Tablette mit einem Durchmesser von 3,5 mm mehr als 27.000 Spektraldatenpunkte erfasst. Die Hauptkomponentenanalyse (PCA) und das Clustering wurden verwendet, um die drei Bestandteile (Acetaminophen, Aspirin und Koffein) sowie Mischungen in den Grenzregionen zu identifizieren. Gleichzeitig wurden Bilder mit polarisiertem Lichtmikroskop (PLM) für die Region aufgenommen und dann zum visuellen Vergleich mit der Raman-Karte überlagert. Die entsprechenden Spektren werden gezeigt, um die hohe Qualität der Daten zu verdeutlichen und die Fähigkeit des TR-WPS zu demonstrieren, Materialien oder Polymorphe schnell zu identifizieren und zu unterscheiden und sowohl visuelle als auch spektrale Daten zu erfassen.
® Excedrin ist eine eingetragene Marke von GlaxoSmithKline
Zusammenfassung
Die THz-Raman-Spektroskopie ermöglicht die berührungslose Analyse von Proben in Echtzeit und liefert Strukturinformationen, die andernfalls eine Probenvorbereitung und Offline-Messungen mit unhandlichen Techniken wie PXRD und ss-NMR erfordern würden. Es ist besonders nützlich, wenn es nahtlos mit konventionellem Raman integriert wird, so dass Proben gleichzeitig auf Zusammensetzung und Struktur untersucht werden können. Dieser Überblick über verschiedene pharmazeutische Anwendungen veranschaulicht die Bandbreite der Einsatzmöglichkeiten, deren Vorteile sich auch direkt auf zahlreiche andere Branchen übertragen lassen, darunter die Polymerwissenschaften, Halbleitermaterialien und Industriechemikalien.
Referenzen
1. P.J. Larkin et al, Polymorph Characterization of Active Pharmaceutical Ingredients (APIs) Using Low-Frequency Raman Spectroscopy, Applied Spectroscopy, Band 68, Nummer 7, 2014
2. Coherent, Inc., Polymorph Identification in Pharmaceuticals, Application Highlights, 2019
3. M. Inoue et al, Real-Time Formation Monitoring of Cocrystals with Different Stoichiometries Using Probe-Type Low-Frequency Raman Spectroscopy, Ind. Eng. Chem. Res., Bd. 56, Nr. 44, 12693–12697, 2017
4. J. Wallace, Terahertz-Raman Instrument Becomes a Crystallinity Phase Monitor, Laser Focus World, 6, 2020
5. T. Koide et al, Identification of Pseudopolymorphism of Magnesium Stearate by Using Low-Frequency Raman Spectroscopy, Org. Process Res. Dev., Bd. 20, 1906–1910, 2016
6. Coherent, Inc., High Throughput Screening Using THz-Raman, Application Highlights, 2020