WHITEPAPER
Eine Einführung in die THz-Raman-Spektroskopie
Überblick
Der Terahertzbereich (THz) des elektromagnetischen Spektrums, der etwa von 0,15 THz bis 6 THz (5 cm-1 bis 200 cm-1) reicht, wird seit langem als Mittel zur Untersuchung niederenergetischer Schwingungsformen von Materialien erforscht. Dieser Bereich ist für Spektroskopiker, die intermolekulare Schwingungen in Kristallen untersuchen, besonders attraktiv [1] und liefert wichtige Informationen über die molekulare Ausrichtung, die viele Schlüsseleigenschaften von Materialien bestimmt. Auf der grundlegendsten Ebene ist die THz-Spektroskopie eine Erweiterung der Absorptionsspektroskopie im fernen Infrarot (FIR). In der Praxis ist es weitaus schwieriger zu implementieren, da es am äußersten unteren Ende des optischen Frequenzbereichs und am äußersten oberen Ende des Frequenzbereichs der Elektronik liegt. Deshalb wird dieser Bereich des Spektrums in der Fachliteratur oft als „Terahertz-Lücke“ bezeichnet [2]. Derzeit sind kommerzielle THz-Spektroskopiesysteme auf dem Markt erhältlich, aber die meisten sind aufgrund der Komplexität der ultraschnellen Laser, die in der Regel zur Erzeugung von THz-Strahlung erforderlich sind, und der Anfälligkeit der Proben für Feuchtigkeit extrem teuer und schwierig zu verwenden.
Glücklicherweise ist die direkte Absorption von Terahertz-Strahlung nicht die einzige Möglichkeit, Zugang zu Schwingungsmoden im THz-Bereich zu erhalten, da viele von ihnen auch Raman-aktiv sind. Die Raman-Streuung beruht auf der inelastischen Streuung von Photonen, nicht auf Absorption, wodurch die Anregungswellenlänge von den untersuchten Schwingungsmoden entkoppelt wird. Beim traditionellen Raman stellt der Spektralbereich von 200 cm-1 bis 1800 cm-1 den „chemischen Fingerabdruck“ dar, da die meisten intramolekularen Schwingungen in diesem Frequenzbereich auftreten. Ergänzend dazu liefert der THz-Raman™-Bereich (auch als Niederfrequenz-Raman oder LFR bezeichnet) von 5 cm-1 bis 200 cm-1 einen „strukturellen Fingerabdruck“, der hauptsächlich intermolekularen Schwingungen oder Gitter-/Phononenmoden des Materials entspricht. Abbildung 1 zeigt die relativen Wellenlängenbereiche, in denen THz-Spektroskopie (50 μm bis 2 mm), IR-Spektroskopie (5 bis 50 μm) und THz-Raman-Spektroskopie im elektromagnetischen Spektrum auftreten. Abbildung 2 zeigt dementsprechend die relative Lage der chemischen und strukturellen Fingerabdrücke eines typischen Raman-Spektrums.
Die Umsetzung der Raman-Spektroskopie im THz-Bereich war in der Vergangenheit eine Herausforderung, da die inelastische Streuung (Raman-Verschiebung) um Größenordnungen schwächer ist als die elastische Streuung (Rayleigh), so dass es schwierig ist, die Rayleigh-Streuung angemessen herauszufiltern. Daher war es schwierig, Signale mit Raman-Verschiebungen nahe der Rayleigh-Linie aufzulösen (0 cm -1). Diese Situation hat sich mit den revolutionären Entwicklungen bei volumenholografischen Notch-Filtern, die es ermöglichen, Raman-Verschiebungen von nur 5 cm-1 mit einem einfachen Monochromator mit hoher optischer Effizienz direkt zu messen, völlig geändert [3]. Dieser Durchbruch hat zu einem Paradigmenwechsel bei der Niederfrequenz-Raman-Technik geführt: von einer relativen Neuheit, die komplexe mehrstufige Monochromatoren erfordert, bis hin zu eigenständigen Spektrometern, die jeder Wissenschaftler in wenigen Minuten einrichten kann, sowie zu Plug-and-Play-Zusatzmodulen für bestehende Geräte. Zu diesen THz-Raman-Modulen gehören beispielsweise Tauchsonden für die Reaktionsüberwachung, Mikroskopplattformen für die Abbildung der Phasenlage von Proben und Well-Plate-Reader für High-Throughput-Screening-Anwendungen mit hohem Durchsatz.
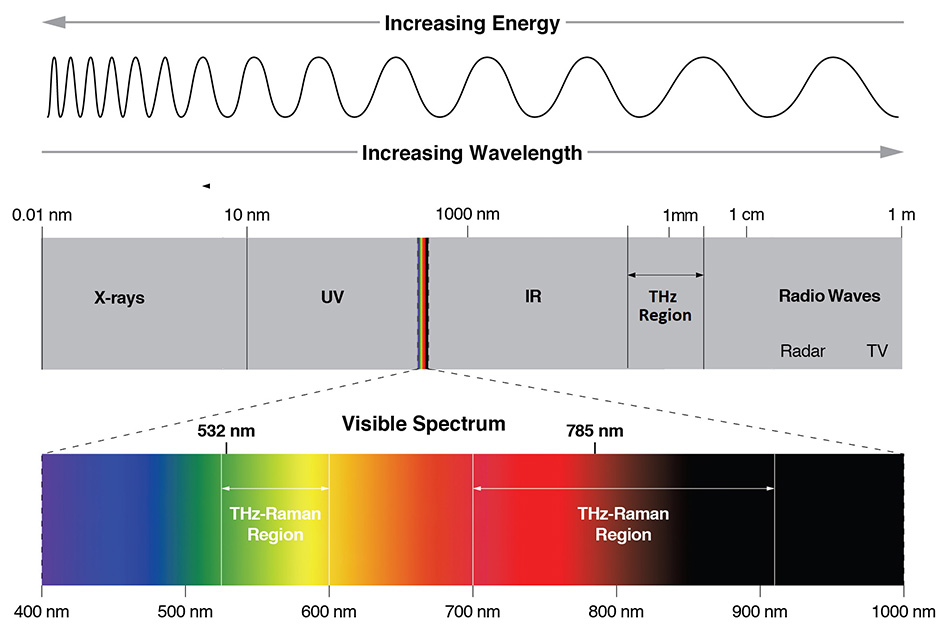
Abbildung 1: Das elektromagnetische Spektrum zeigt die Standorte der verschiedenen Spektroskopietechniken. Raman-Spektroskopie wird in der Regel im sichtbaren (532 nm) oder NIR-Bereich (785 nm) durchgeführt, während IR-Absorptionsspektroskopie im Bereich von 5 – 50 μm und THz-Spektroskopie im Bereich von 50 μm – 2 mm stattfindet.
THz-Raman-Systemanforderungen
Jedes THz-Raman-System hat vier Dinge gemeinsam:
- Eine wellenlängenstabilisierte Laserquelle
- Schmalband (< 5 cm-1) spektrale Reinigungsfilter
- Schmalband (< 5 cm -1) Rayleigh-Streuung blockierende Filter
- Ein Spektrometer, das die niederfrequenten Signale erkennen kann
Der Rayleigh-Filter, ein Notch-Filter mit einer Bandbreite von +/- 5 cm1, sollte der begrenzende Faktor dafür sein, wie tief in den THz-Bereich hinein das System detektieren kann. Damit der Rayleigh-Filter ordnungsgemäß funktioniert, muss das Ausgangsspektrum des Lasers jedoch extrem stabil sein, eine sehr schmale Linienbreite aufweisen und ein extrem geringes Rauschen durch verstärkte Spontanemission (ASE) oder Seitenbänder im Übertragungsbereich der Kerbfilter aufweisen. Außerdem ist es wichtig, dass die Mittenwellenlängen der Filter und des Lasers während des Betriebs „spektral synchronisiert“ bleiben, um ein Entweichen des Rayleigh-Signals und eine Sättigung des Detektors des Spektrometers zu vermeiden. Als integrierter Hersteller von Lasern, Filtern und optischen Systemen sind alle Spektrometer und Module von Coherent so konzipiert, dass sie diese Synchronisation perfekt aufrechterhalten und jederzeit eine robuste, einfach zu bedienende Leistung gewährleisten.
Ein zusätzlicher Vorteil dieser Systeme besteht darin, dass Raman-Spektren als relative Verschiebung gegenüber der Laserfrequenz gemessen werden. THz-Raman-Systeme können Laser mit beliebigen Wellenlängen im sichtbaren oder nahen Infrarot (NIR) verwenden, um diese niederenergetischen Schwingungsmoden zu untersuchen, wodurch eine THz-Laserquelle überflüssig wird. Dies ermöglicht eine wesentlich einfachere und kosteneffektivere Spektralsammlung, die den Einsatz von Glasoptiken und -fasern, kompakten und kosteneffektiven Dioden- und diodengepumpten Festkörperlaserquellen (DPSS) sowie Siliziumdetektoren und -detektoranordnungen erlaubt. THz-Raman-Systeme sind auch in der Lage, Anti-Stokes-Raman-Verschiebungen von weniger als -5 cm-1 zu erkennen, die zusätzliche Informationen über die Probe liefern, einschließlich der lokalen effektiven Temperatur. Daher können THz-Raman-Systeme gleichzeitig die chemischen und strukturellen Fingerabdrücke von Materialien mit hohem Durchsatz in einer einzigen Messung messen.
Die Kombination der Vorteile der THz-Spektralinformationen mit der Benutzerfreundlichkeit der Raman-Spektroskopie macht diese nun zu einer leistungsstarken Lösung für Anwendungen, die sowohl an den chemischen als auch an den strukturellen Eigenschaften von Materialien interessiert sind. THz-Raman hat sich in der pharmazeutischen Industrie schnell durchgesetzt [4-9] und findet auch bei Polymeren [10], Halbleitern [11-13] und in der biomedizinischen Diagnostik [14] zunehmend Anklang.
Niederfrequente Schwingungsmodi
Wie oben beschrieben, resultieren niederfrequente Peaks aus intermolekularen Schwingungen wie Phononmoden und Gitterschwingungen. Bei kristallinen Proben ist die Position (Verschiebung) der Peaks spezifisch für die Zusammensetzung (chemische und strukturelle) Details des Kristalls. Und die Bandbreite und Intensität dieser scharfen niederfrequenten Spitzen stehen in direktem Zusammenhang mit dem Strukturgrad (Kristallinität) der Probe. Im Gegensatz dazu weisen amorphe Feststoffe und Flüssigkeiten einen breiten, unaufgelösten Peak auf, der als Boson-Peak bekannt ist. Daher ist das THz-Raman-Spektrum ein nützliches Instrument zur quantitativen Analyse der Kristallinität von Proben und zur Klassifizierung verschiedener Allotrope und Polymorphe. Obwohl die polymorphe Analyse eine populärere Anwendung ist, ist es einfacher, die THz-Raman-Spektren verschiedener Allotrope zu untersuchen, um die Eigenschaften der niederfrequenten Schwingungsmoden besser zu veranschaulichen.
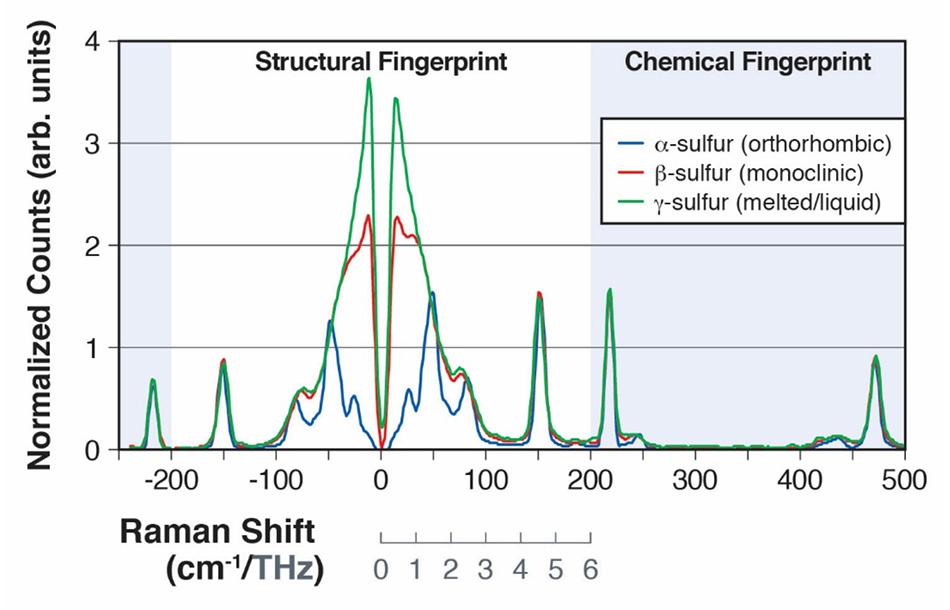
Abbildung 2: Raman-Spektren von α-Schwefel und β-Schwefel, die die intermolekularen Schwingungsmoden von 0 bis 200 cm-1 (A) und intramolekulare Schwingungsmoden von 200 cm-1 bis 500 cm-1 (B) zeigen.
Schwefel, der mehr als 30 Allotrope hat, wurde aufgrund seiner Bedeutung für eine Vielzahl chemischer Prozesse sowohl in den Biowissenschaften als auch in industriellen Anwendungen eingehend untersucht [15]. Das Allotrop α-Schwefel weist nachweislich 24 verschiedene intermolekulare Schwingungen auf, von denen viele im 30-cm -1- bis 100-cm -1-Bereich des Spektrums Raman-aktiv sind [16]. In einem auf der SPIE-Konferenz für Verteidigung, Sicherheit und Sensorik 2013 vorgestellten Beitrag zeigten Heyler et al., wie diese Schwingungsmoden mit THz-Raman nachgewiesen werden können [3]. Sie zeigten weiter, dass die α-Schwefelprobe bei einer Erhitzung über 95,6 °C eine Formänderung zum Allotrop β-Schwefel erfuhr und sich dann bei 115,2 °C verflüssigte. Der Übergang von der α-Form (orthorhombisch) zur weniger geordneten β-Form (monoklin) konnte leicht erkannt werden, da die zunehmende Unordnung zu einer „Unschärfe“ der Moden im Raman-Spektrum unterhalb von 100 cm-1 führt, da es sich eher einer Bosonen-Peak-Struktur nähert [Abbildung 2]. Nach dem Schmelzen und der Bildung der y-Form (Flüssigkeit) verschmelzen die Strukturmoden im THz-Raman-Bereich vollständig und zeigen nur noch das für eine gewöhnliche Flüssigkeit typische reine Bosonenband [17]. Im Gegensatz dazu wurden die Moden im Bereich des chemischen Fingerabdrucks durch die Formänderung nicht wesentlich beeinflusst, wie ein Vergleich der Peakpositionen der Spektren oberhalb von 100 cm-1 zeigt. Alle Spektren in Abbildung 2 wurden mit dem Coherent TR-MICRO THz-Raman-Modul aufgenommen, das an ein aufrechtes Mikroskop und ein fasergekoppeltes Spektrometer angeschlossen ist. Eine schematische Darstellung des Aufbaus ist in Abbildung 3 zu sehen.
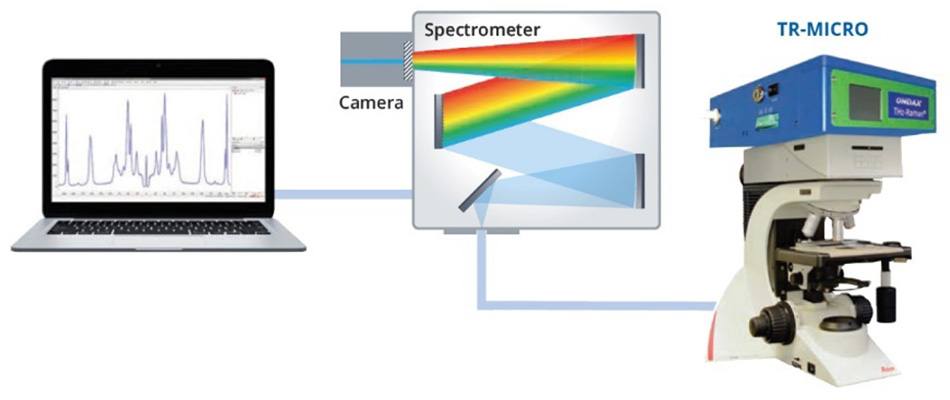
Abbildung 3:Schematische Darstellung des Versuchsaufbaus zur Erfassung der THz-Raman-Spektren von α-Schwefel und β-Schwefel.
Die THz-Raman-Einheit enthält einen Einfrequenz-Anregungslaser, der genau auf ultra-schmalbandige (volumenholografische) Laserlinien- und Kerbfilter abgestimmt ist. Die Notch-Filter wurden speziell entwickelt, um einen maximalen Durchsatz der Raman-Streuung zu gewährleisten und gleichzeitig die Rayleigh-Streuung mit einer optischen Dichte (OD) von mehr als 9 zu dämpfen, so dass sie auch bei inhomogenen Proben eingesetzt werden können. Schließlich wird die verbleibende Raman-Streuung über ein Glasfaserkabel in ein Spektrometer eingekoppelt. Eine detailliertere Erläuterung des optischen Designs findet sich in den Konferenzunterlagen [3].
Anwendungen in der Pharmazie
Polymorphismus ist ein kritisches und häufiges Merkmal pharmazeutischer Wirkstoffe (API). Sie hat einen direkten Einfluss auf die Bioverfügbarkeit, die Herstellbarkeit und die Qualität/Leistung von Arzneimitteln [18]. Da polymorphe Verbindungen dieselbe molekulare Grundzusammensetzung, aber unterschiedliche strukturelle Ausrichtungen aufweisen, eignet sich THz-Raman viel besser als herkömmliche Infrarot- (IR) und Raman-Spektroskopie zur Bestimmung der polymorphen Form. Der Vollständigkeit halber sei darauf hingewiesen, dass in einigen Fällen polymorphe Unterschiede aufgrund der Dämpfung intramolekularer Schwingungen zu subtilen Peakverschiebungen im chemischen Fingerabdruckbereich der Raman-Spektren führen können [19,20]. Allerdings sind die spektralen Veränderungen im Niederfrequenzbereich in der Regel viel ausgeprägter (bis zu 10-mal stärker) und leichter zu unterscheiden, ohne dass eine komplexe chemometrische Analyse erforderlich ist. Darüber hinaus haben Larkin et al. in einem 2014 in Applied Spectroscopy veröffentlichten Artikel gezeigt, dass „niederfrequente Raman-Spektren großer aromatischer Spezies, wie sie für Wirkstoffe typisch sind, bemerkenswert intensive Banden unterhalb von 200 cm-1 mit komplexen spektralen Merkmalen aufweisen [9]“. Sie erklärten weiter, dass diese Banden typischerweise um eine Größenordnung intensiver sind als die der umgebenden Hilfsstoffe im gleichen Frequenzbereich, wodurch THz-Raman in der Lage ist, „kristalline Struktur, kristalline Unordnung und amorphe Zustände“ mit erhöhter Empfindlichkeit direkt zu messen.

Abbildung 4: Das TR-BENCH, ein Tisch-THz-Raman-Modul von Coherent.
Zwischen der oben genannten Studie [9] und einer 2015 veröffentlichten Folgestudie [10] haben Forscher von Bristol-Myers Squibb eine detaillierte Analyse der niederfrequenten Raman-Banden für polymorphe Formen einiger gängiger Wirkstoffe vorgelegt. In diesen beiden Veröffentlichungen wurden Indomethacin, Carbamazepin, Koffein, Theophyllin und Apixaban untersucht. Larkin et al. verwendeten ein THz-Raman-Sampling-System, das dem TR-BENCH ähnelt, das derzeit von Coherent erhältlich ist (siehe Abbildung 4). Das TR-BENCH hat die gleiche interne optische Architektur wie das im vorherigen Abschnitt beschriebene TR-MICRO. Als Beispiel für diese Forschung zeigt Abbildung 5 die THz-Raman-Spektren von drei verschiedenen Formen von Carbamazepin.
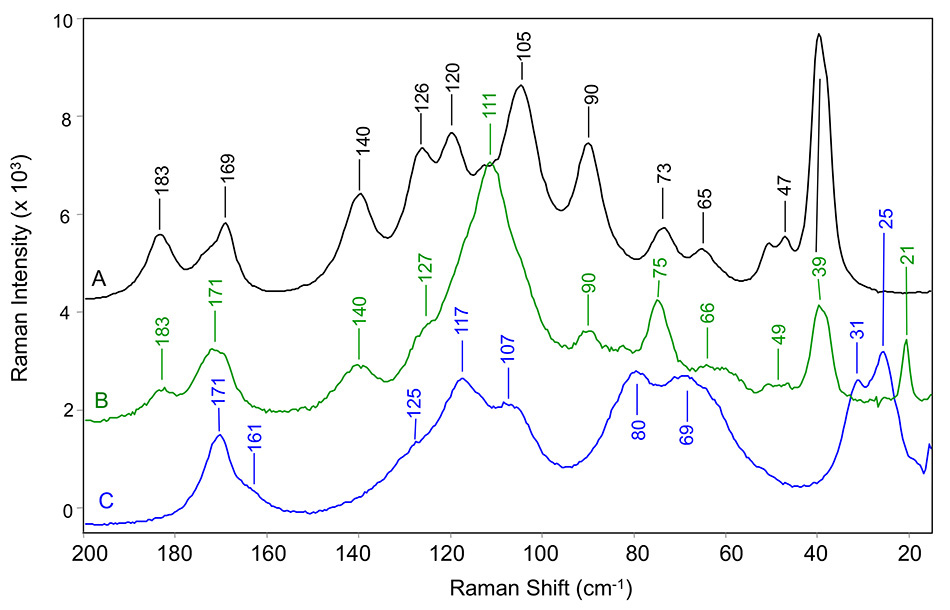
Abbildung 5: THz-Raman-Spektren von Carbamazepin in (A) Form III, (B) pseudopolymorpher Dihydratform und (C) Form II. Alle Werte wurden bei Raumtemperatur gemessen [8].
In den letzten Jahren hat die THz-Raman-Spektroskopie den Weg aus den Forschungslabors in die pharmazeutische Prozessüberwachung gefunden, die oft als Prozessanalytik (PAT) bezeichnet wird [21-24]. In Prozessanwendungen ermöglichen fasergekoppelte THz-Raman-Sonden Inline-, Online- und Atline-Messungen, bei denen das Analysegerät von der Probe entfernt sein kann und die Probe nicht erfasst und zum Analysegerät gebracht werden muss. Je nach Anforderung kann die Sondenspitze mit einem kurzen Arbeitsabstand für das direkte Eintauchen in eine Reaktionskammer durch eine Zugangsöffnung oder mit einem längeren Arbeitsabstand für das Sammeln von Spektren durch ein Sichtfenster ausgeführt werden. Abbildung 6 zeigt ein Beispiel der TR-PROBE mit einer angebrachten Tauchsondenspitze.

Abbildung 6: Das TR-PROBE, THz-Raman-Sondenmodul, mit angebrachter 11" langer Edelstahl-Tauchspitze von Coherent.
Inoue et al. verwendeten diesen Ansatz, um den Übergang von Carbamazepin Form III zu Carbamazepin-Dihydrat für verschiedene Konzentrationen von Ethanol und Wasser zu überwachen [22]. Die in Abbildung 7 dargestellten Ergebnisse wurden mit einem multivariaten Kurvenauflösungsalgorithmus (MCR) mit den dominanten THz-Raman-Banden von Carbamazepin-Dihydrat (111 cm-1) und Carbamazepin III (39 cm-1) berechnet. Anhand dieser Daten konnten die Forscher feststellen, dass die Reaktion mit einer Lösung aus 62,5 % Ethanol und 37,5 % Wasser am schnellsten umgesetzt werden konnte.
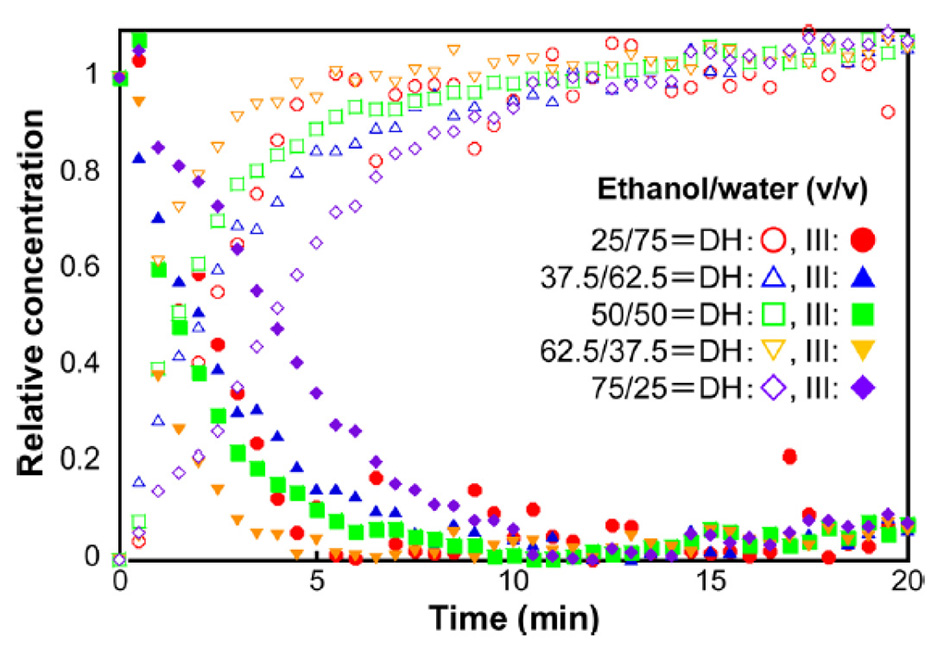
Abbildung 7: Konzentrationskinetik der Umwandlung von Carbamazepin Form III in Carbamazepin-Dihydrat bei verschiedenen Lösungsmittelverhältnissen von Ethanol und Wasser [21].
Die Zukunft von THz-Raman
Die pharmazeutische Industrie war die erste, die THz-Raman in großem Umfang einsetzte, aber auch andere Branchen nutzen es zur Analyse von Kristallinität und Polymorphismus. Ein aktuelles Beispiel ist die Verwendung von THz-Raman zur Erforschung der Beziehung zwischen Mobilität und Dehnung [25] sowie des Ladungstransports und niederfrequenter Schwingungen [12] in organischen Halbleitern. Sie wird auch zur Analyse von Phononenmoden in Quantenpunkten [11] und geschichteten Halbleiterlegierungen [13] verwendet. Kürzlich wurden auch Studien über die Kristallisation von Polymeren [10] und die Bildung von Lamellen während des Abkühlungsprozesses [26] veröffentlicht, die wichtige Informationen über die strukturellen Eigenschaften von Produkten für die Polymerindustrie liefern. Die vielleicht aufregendsten zukünftigen Anwendungen von THz-Raman liegen in der Biologie und der biomedizinischen Diagnostik. Auf der SPIE BiOS-Konferenz 2019 in San Francisco präsentierten Marble et al. den ersten Vortrag über die Verwendung von THz-Raman für biologische Moleküle [14], und ein Jahr später wurde THz-Raman bereits als potenzielles Diagnoseinstrument für COVID-19 erforscht [27].
Zusammenfassung
Es hat sich wiederholt gezeigt, dass THz-Raman den Benutzern robuste und gleichzeitige Informationen über die strukturelle und chemische Zusammensetzung liefert. Es besteht kein Zweifel daran, dass die Anwendungen weiter wachsen und sich ausweiten werden, wenn THz-Raman-Analysatoren den Weg aus dem Labor in die industrielle Umgebung finden. An dieser Stelle ist es unvermeidlich, dass die Forscher weiterhin neue Anwendungen für die hochdifferenzierten Informationen finden, die durch THz-Raman aufgedeckt werden, die bisher noch nicht erdacht wurden. Wenn Sie weitere Informationen über THz-Raman-Instrumente, Anwendungen oder Möglichkeiten wünschen, besuchen Sie bitte www.thz-raman.com oder fordern Sie über unsere Website www.coherent.com ein Beratungsgespräch mit einem Anwendungswissenschaftler an.
Referenzen:
[1] El Haddad, J., Bousquet, B., Canioni, L. und Mounaix, P., 2013. Review in Terahertz Spectral Analysis. TrAC Trends in Analytical Chemistry, 44, S. 98–105.
[2] Dexheimer, S.L. ed., 2017. Terahertz spectroscopy: principles and applications. CRC press.
[3] Heyler, R.A., Carriere, J.T. and Havermeyer, F., 2013, May. THz-Raman: accessing molecular structure with Raman spectroscopy for enhanced chemical identification, analysis, and monitoring. In Next-Generation Spectroscopic Technologies VI (Vol. 8726, S. 87260J). International Society for Optics and Photonics.
[4] Gato, K., Fujii, M.Y., Hisada, H., Carriere, J., Koide, T. and Fukami, T., 2020. Molecular state evaluation of active pharmaceutical ingredients in adhesive patches for transdermal drug delivery. Journal of Drug Delivery Science and Technology, S. 101800.
[5] Koide, T., Fukami, T., Hisada, H., Inoue, M., Carriere, J., Heyler, R., Katori, N., Okuda, H. and Goda, Y., 2016. Identification of pseudopolymorphism of magnesium stearate by using low-frequency Raman spectroscopy. Organic Process Research & Development, 20(11), S.1906–1910.
[6] Tanabe, Y., Maeno, Y., Ohashi, K., Hisada, H., Roy, A., Carriere, J., Heyler, R. and Fukami, T., 2019. Screening a trace amount of pharmaceutical cocrystals by using an enhanced nano-spot method. European Journal of Pharmaceutics and Biopharmaceutics, 136, S. 131–137.
[7] Larkin, P.J., Wasylyk, J. and Raglione, M., 2015. Application of low-and mid-frequency Raman spectroscopy to characterize the amorphous-crystalline transformation of indomethacin. Applied Spectroscopy, 69(11), S. 1217–1228.
[8] Larkin, P.J., Dabros, M., Sarsfield, B., Chan, E., Carriere, J.T. and Smith, B.C., 2014. Polymorph characterization of active pharmaceutical ingredients (APIs) using low-frequency Raman spectroscopy. Applied Spectroscopy, 68(7), S. 758–776.
[9] Walker, G., Römann, P., Poller, B., Löbmann, K., Grohganz, H., Rooney, J.S., Huff, G.S., Smith, G.P., Rades, T., Gordon, K.C. and Strachan, C.J., 2017. Probing pharmaceutical mixtures during milling: The potency of low-frequency Raman spectroscopy in identifying disorder. Molecular Pharmaceutics, 14(12), S. 4675–4684.
[10] Marlina, D., Hoshina, H., Ozaki, Y. and Sato, H., 2019. Crystallization and crystalline dynamics of poly (3-hydroxybutyrate)/poly (4-vinylphenol) polymer blends studied by low-frequency vibrational spectroscopy. Polymer, 181, S. 121790.
[11] Mork, A.J., Lee, E.M., Dahod, N.S., Willard, A.P. and Tisdale, W.A., 2016. Modulation of low-frequency acoustic vibrations in semiconductor nanocrystals through choice of surface ligand. The journal of physical chemistry letters, 7(20),S. 4213–4216.
[12] Sosorev, A.Y., Maslennikov, D.R., Kharlanov, O.G., Chernyshov, I.Y., Bruevich, V.V. and Paraschuk, D.Y., 2019. Impact of Low‐Frequency Vibrations on Charge Transport in High‐Mobility Organic Semiconductors. physica status solidi (RRL)–Rapid Research Letters, 13(3), S.1800485.
[13] Tharith, S., Hai, N.T.M., Lee, Y., Lim, S.Y., Van Quang, N., Kwanpyo, K., Sunglae, C. and Hyeonsik, C., 2020. Optical phonons of SnSe (1− x) S x layered semiconductor alloys. Scientific Reports (Nature Publisher Group), 10(1).
[14] Marble, K.S., Noojin, G.D., Coker, Z.N., Lalonde, J.W., Denton, M.L., Echchgadda, I., Yakovlev, V.V. and Cantu, J., 2019, March. Implementing low-frequency Raman spectroscopy to study biological molecules (Konferenzpräsentation). In Optical Interactions with Tissue and Cells XXX (Vol. 10876, S. 108760H). International Society for Optics and Photonics.
[15] Steudel, R. and Eckert, B., 2003. Solid sulfur allotropes. In Elemental sulfur and sulfur-rich compounds I (S. 1-80). Springer, Berlin, Heidelberg.
[16] Eckert, B. and Steudel, R., 2003. Molecular spectra of sulfur molecules and solid sulfur allotropes. In Elemental Sulfur und Sulfur-Rich Compounds II (S. 31-98). Springer, Berlin, Heidelberg.
[17] Raw, A.S., Furness, M.S., Gill, D.S., Adams, R.C., Holcombe Jr, F.O. and Lawrence, X.Y., 2004. Regulatory considerations of pharmaceutical solid polymorphism in Abbreviated New Drug Applications (ANDAs). Advanced drug delivery reviews, 56(3), S. 397–414.
[18] Bras, L.P. and LOUREIRO, R., 2013. Polymorphic conversion monitoring using real-time Raman spectroscopy. Chimica Oggi-Chemistry Today, 31, S. 5.
[19] Mazivila, S.J., Nogueira, H.I., Páscoa, R.N., Ribeiro, D.S., Santos, J.L., Leitão, J.M. and da Silva, J.C.E., 2020. Portable and benchtop Raman spectrometers coupled to cluster analysis to identify quinine sulfate polymorphs in solid dosage forms and antimalarial drug quantification in solution by AuNPs-SERS with MCR-ALS. Analytical Methods, 12(18), S. 2407–2421.
[20] Otaki, T., Tanabe, Y., Kojima, T., Miura, M., Ikeda, Y., Koide, T. and Fukami, T., 2018. In situ monitoring of cocrystals in formulation development using low-frequency Raman spectroscopy. International journal of pharmaceutics, 542(1-2), S. 56–65.
[21] Inoue, M., Hisada, H., Koide, T., Carriere, J., Heyler, R. and Fukami, T., 2017. In situ monitoring of crystalline transformation of carbamazepine using probe-type low-frequency Raman spectroscopy. Organic Process Research & Development, 21(2), S. 262–265.
[22] Nomura, K., Titapiwatanakun, V., Hisada, H., Koide, T. and Fukami, T., 2020. In situ monitoring of the crystalline state of active pharmaceutical ingredients during high-shear wet granulation using a low-frequency Raman probe. European Journal of Pharmaceutics and Biopharmaceutics, 147, S.1–9.
[23] Walker, G., Römann, P., Poller, B., Löbmann, K., Grohganz, H., Rooney, J.S., Huff, G.S., Smith, G.P., Rades, T., Gordon, K.C. and Strachan, C.J., 2017. Probing pharmaceutical mixtures during milling: The potency of low-frequency Raman spectroscopy in identifying disorder. Molecular Pharmaceutics, 14(12), S. 4675–4684.
[24] Choi, H.H., Yi, H.T., Tsurumi, J., Kim, J.J., Briseno, A.L., Watanabe, S., Takeya, J., Cho, K. and Podzorov, V., 2020. A Large Anisotropic Enhancement of the Charge Carrier Mobility of Flexible Organic Transistors with Strain: A Hall Effect and Raman Study. Advanced Science, 7(1), S. 1901824.
[25] Samuel, A.Z. and Hamaguchi, H.O., 2018. A General Approach for Estimating Lamella‐Thickness Distribution in Polymers with Low‐Frequency Raman Spectroscopy: Application to Lamella Formation in Crystallizing Polyethylene. Chemistry–A European Journal, 24(37), S. 9333–9339.
[26] Damle, V.H., Rajeswaran, B. and Tischler, Y.R., 2020. Low-Frequency Raman Spectroscopy as a Diagnostic Tool for COVID-19 and other Coronaviruses. Royal Society Open Science (Im Freigabe-Prozess).