ERFOLGSGESCHICHTE EINES KUNDEN
Zwei-Photonen-Metabol-FLIM mit dem Coherent Axon 780 Faserlaser
Becker & Hickl GmbH – ein Technologieführer für die Photonenzählung – hat bereits gezeigt, dass kleine Femtosekunden-Faserlaser als preiswerte Anregungsquellen für Multiphotonen-Fluoreszenzbildgebungssysteme verwendet werden können. Mit einer Wellenlänge von 780 nm, 40 MHz bis 80 MHz Pulsrate und einer durchschnittlichen Leistung von 100 mW bis 500 mW eignen sich die Laser nicht nur für die Anregung von NAD(P)H, sondern auch für eine Vielzahl anderer Fluorophore [1, 2], einschließlich solcher mit extrem kurzer Fluoreszenzlebensdauer [3, 4, 5].
Becker und Hickl waren daher daran interessiert, zu sehen, wie sich der Axon Femtosekunden-Laser bei diesen Anwendungen verhalten würde.

Abb. 1: Coherent Axon 780 Laser
Systemarchitektur
Als Testsystem verwendeten sie ein bh DCS-120 MP Multiphotonen-FLIM-System. Die Architektur dieses Systems ist in Abb. 2 dargestellt.
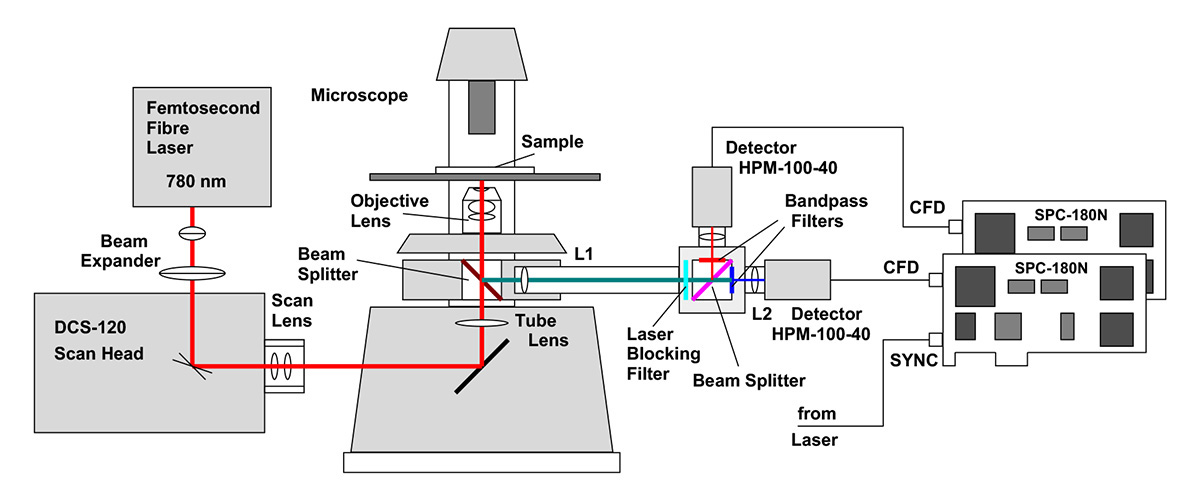
Für eine maximale räumliche Auflösung ist es wichtig, dass der Laserstrahl die hintere Öffnung der Linse vollständig füllt. Bei den üblichen Brennweiten der Scan- und Rohrlinsen ist dies nicht automatisch der Fall. Der Strahl wird daher um den Faktor 1,5 erweitert, bevor er in den Scanner eintritt. Der Strahldurchmesser in der hinteren Öffnung beträgt etwa 12 mm, was ausreicht, um die Öffnung selbst der größten Mikroskoplinsen zu füllen. Die Überfüllung der Öffnung ist unproblematisch. Der damit verbundene Verlust der Anregungsleistung kann toleriert werden, da der Laser viel mehr Leistung liefert als benötigt.
Fluoreszenzlicht von der Probe wird durch die Linse zurückgeführt und über einen nicht abgetasteten Strahlengang geführt. L1 und L2 bilden ein Endoskop. Das Endoskop sammelt auch Photonen, die von der Linse nicht perfekt kollimiert werden, z. B. Photonen, die auf dem Weg aus einer dicken Probe gestreut werden. Das Fluoreszenzlicht wird in zwei Wellenlänge aufgeteilt und von zwei bh HPM-100-40 Hybriddetektoren erkannt [6, 7]. Die Einzelphotonenpulse der Detektoren werden in zwei SPC-180N TCSPC/FLIM-Modulen aufgezeichnet [1]. Die SPC-180N-Module bestimmen die Erkennungszeiten der Photonen nach den Anregungspulsen und die Position des Scanners im Moment der Photonenerkennung. Diese Informationen werden zum Erstellen der FLIM-Bilder verwendet. Dabei handelt es sich um Pixel-Arrays, wobei jedes Pixel in einer großen Anzahl von Zeitkanälen eine vollständige Fluoreszenzabfallkurve enthält [1].
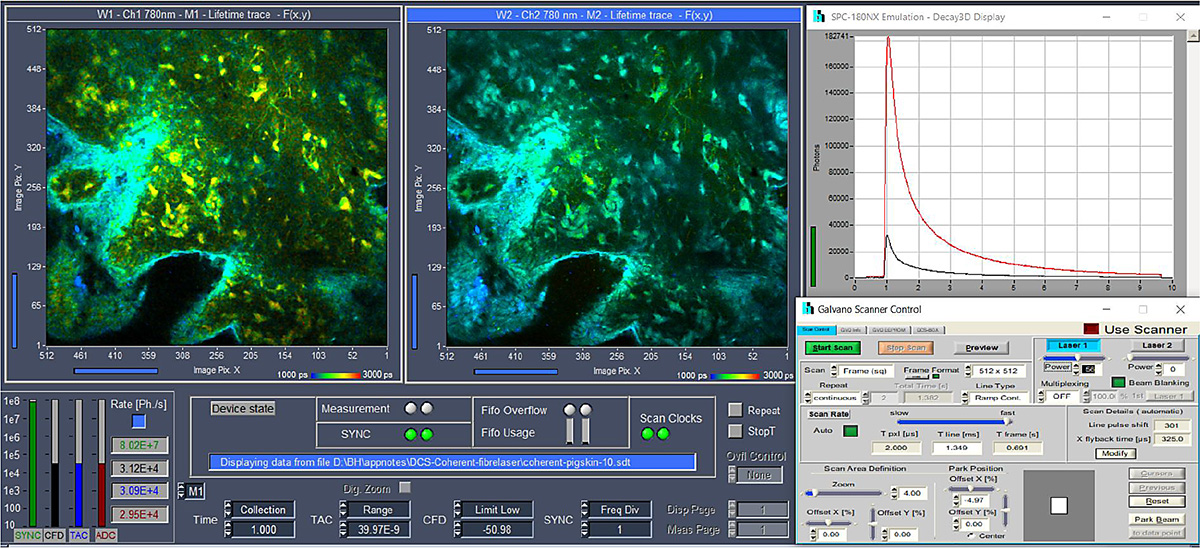
Das Scannen des Laserstrahl und der Strahlausblendung in den Flyback-Phasen wird hardwaregesteuert durch eine bh GVD-140 Scan Controller-Karte. Die Steuerung der Laserintensität erfolgt über den AOM-Steuersignaleingang des Axon-Laser. Dieses Signal wird auch von der GVD-140-Karte bereitgestellt. Das gesamte System wird von der SPCM-Datenerfassungs- und Steuerungssoftware [1] von bh betrieben, die ein vollständig integriertes FLIM-System mit Scannersteuerung, Laser, Datenerfassung und Datenanalyse bietet. Die Benutzeroberfläche des FLIM-Systems ist in Abb. 3 dargestellt.
Ergebnis
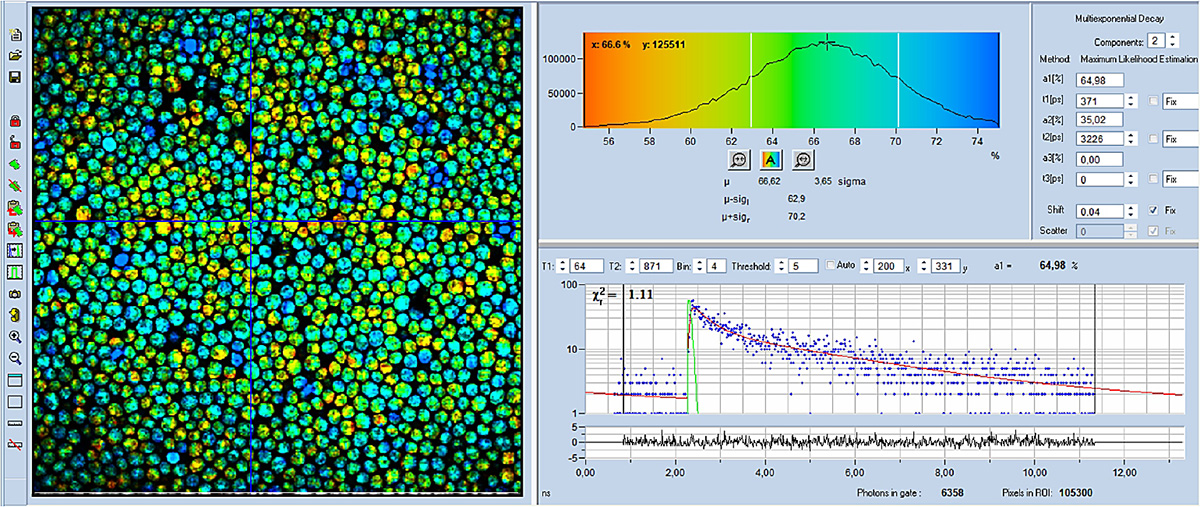
FLIM-Bilder, die mit der DCS-120-AXON-Kombination aufgenommen wurden, sind in Abb. 4 bis Abb. 6 dargestellt. Für alle Bilder wurde eine 40x, NA= 1,3 Linse verwendet. Die Datenanalyse wurde mit der bh SPCImage NG FLIM Data Analysis Suite durchgeführt. Abb. 4 und Abb. 5 zeigen farbcodierte FLIM-Bilder der mittleren (amplitudengewichteten) Lebensdauer und des Stoffwechselindikators, a1. Ein Histogramm des ausgewählten Bildparameters (tm oder a1) wird oben rechts angezeigt, eine Abklingkurve an der Cursorposition wird unten rechts angezeigt. Die Abklingparameter am ausgewählten Punkt werden ganz rechts angezeigt.
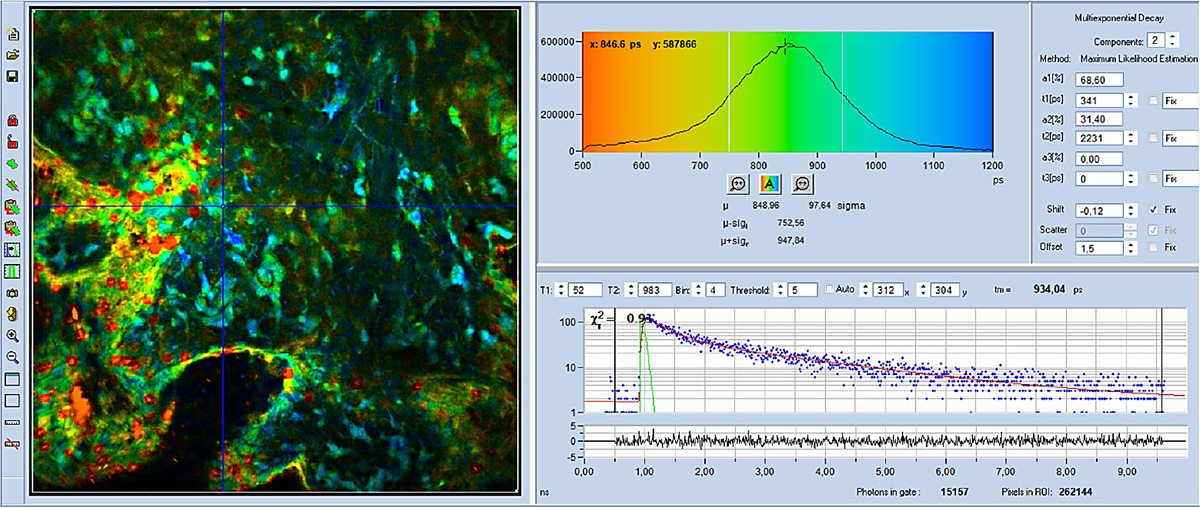
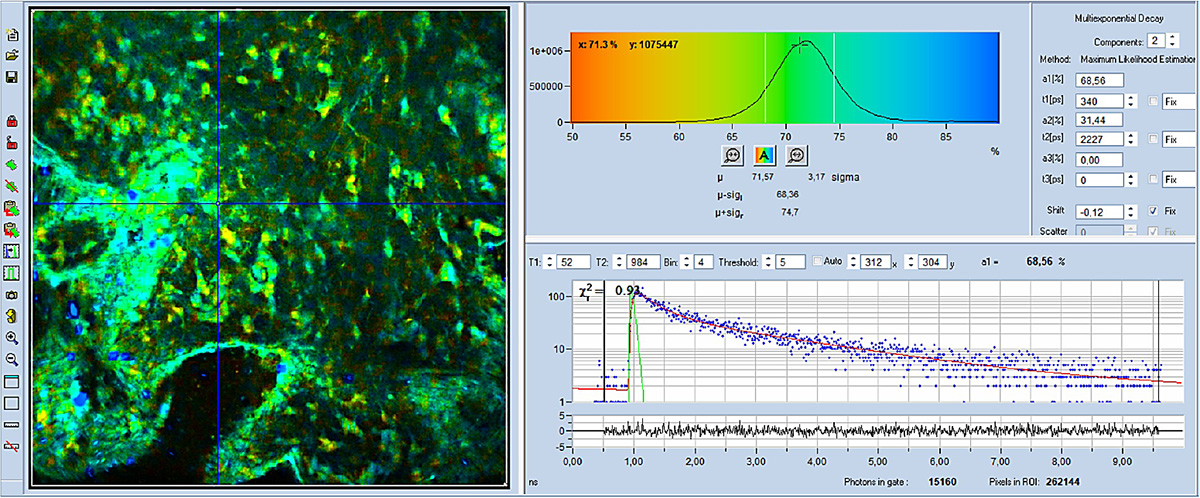
Wie zu sehen ist, ist a1 in verschiedenen Zellen deutlich anders. Dies zeigt an, dass der Stoffwechselzustand in verschiedenen Zellen unterschiedlich ist. Eine hohe a1 (blau dargestellt) zeigt an, dass die Metabolisierung glykolitischer ist, eine niedrige a1 ( gelb) zeigt, dass sie oxydativer ist.
Referenzen
- W. Becker, Das bh TCSPC Handbuch. 10. Ausgabe. Becker & Hickl GmbH (2023), verfügbar unter www.becker-hickl.com, gedruckte Kopien erhältlich bei bh
- W. Becker, C. Junghans, H. Netz, Zwei-Photonen-FLIM mit einem Femtosekunden-Faserlaser. Anwendungshinweis, verfügbar auf www.becker-hickl.com
- W. Becker, C. Junghans, A. Bergmann, Two-Photon FLIM of Mpilroom Spores enthüllt ultraschnelle Zerfallskomponenten. Anwendungshinweis (2021), verfügbar unter www.becker-hickl.com
- W. Becker, A. Bergmann, C. Junghans, Ultra-Fast Fluorescence Decay in Natürliche Carotinoide. Anwendungshinweis, becker-hickl.com (2022)
- W. Becker, C. Junghans, V. Shcheslavskiy, hochauflösendes Multiphotonen-FLIM zeigt ultraschnellen Fluoreszenzabfall im menschlichen Haar. Anwendungshinweis, becker-hickl.com (2023)
- W. Becker, B. Su, K. Weisshart, O. Holub, FLIM und FCS Detection in Laser-Scanning Microscopes: Gesteigerte Effizienz durch GaAsP Hybriddetektoren. Migr. Res. Tech. 74, 804-811 (2011)
- Becker & Hickl GmbH, Sub-20ps IRF-Breite von Hybriddetektoren und MCP-PMTs. Anwendungshinweis, verfügbar auf www.becker-hickl.com
„Wir haben demonstriert, dass der Coherent Axon 780 Femtosekunden-Laser in Kombination mit bhs PräzisionsscannerOptiken, Detektoren, TCSPC/FLIM-Elektronik und Datenanalysesoftware genaue Informationen über die Metabolisierung lebender Zellen und Gewebe liefert.“
– Wolfgang Becker, Geschäftsführer, Becker & Hickl GmbH, Berlin, Deutschland

